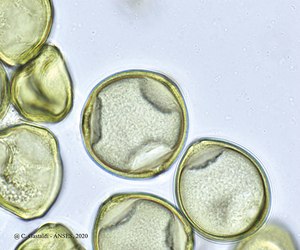
Deux types principaux de microscopes sont utilisés pour l’analyse du pollen : le microscope optique et le microscope électronique. Chaque type de microscope a ses avantages et ses inconvénients. Le microscope optique est le plus utilisé. Il est facilement accessible car beaucoup de laboratoires en possèdent. Par contre, l’identification du pollen peut être plus difficile à cause du manque de résolution comparé à un microscope électronique. En microscopie optique, la préparation sera traversée par les rayons lumineux tandis que par microscopie électronique à transmission, les électrons remplacent les rayons lumineux. En microscopie électronique balayage, la surface de l’échantillon est balayée par les électrons. On obtient ainsi une image en relief. Il est possible d’avoir un grossissement maximal de 300 000 fois, en théorie, mais 100 000 en pratique, tandis qu’en microscopie optique on ne peut dépasser le grossissement de 2 000 fois. Cette limite est imposée par la longueur d’onde de la lumière naturelle.
Les techniques de préparation du pollen pour observation sont différentes selon qu’il s’agisse de microscopie optique ou de microscopie électronique.
Les grains de pollen peuvent être récupérés sur le corps de l’abeille (organes internes ou externes), mais il peut s’agir également du pollen présent dans les trappes à pollen, le pain d’abeille, le miel, …
Parmi les techniques utilisées en microscopie optique, nous allons d’abord présenter la méthode proposée par Wodehouse (1935).
Pour cette méthode, il faut déposer une petite quantité du pollen à analyser sur une lame de microscope. Ensuite, on dépose sur l’échantillon entre 1 à 4 gouttes d’alcool, en laissant les gouttes s’évaporer partiellement. Un halo d’une substance huileuse se formera autour de l’échantillon sur la lame de microscope. Il faudra nettoyer ce halo en utilisant un coton-tige humidifié avec de l’alcool. Ensuite, il faut ajouter une goutte de gélatine glycérinée phéniquée chaude. L’échantillon est homogénéisé et distribué en utilisant une aiguille. Pour que la gélatine ne durcisse pas, la lame est réchauffée en la passant sur la flamme d’un briquet. Finalement, la préparation doit être couverte avec une lamelle. Une fois que la préparation est refroidie, la lamelle peut être lutée avec du vernis à ongles.
Pour préparer la gélatine glycérinée, il faut mélanger une feuille de gélatine (7 g) avec 42 ml d’eau distillée ou osmosée, et 50 ml de glycérol. Cette préparation est réalisée sur une plaque chauffante à 42°C. Il convient d’ajouter 0,5 g de phénol (= acide phénique) afin d’éviter le développement de microbes et de la formation de moisissure dont la présence est extrêmement gênante. Actuellement, cette préparation est proposée prête à l’emploi par les fournisseurs de consommables de laboratoire.
Pour avoir plus de contraste il est possible d’ajouter à la préparation de gélatine glycérinée, un µl de fuchsine basique à 1 %, ou d’autres colorants comme le vert de méthyle, le bleu coton, ou la safranine. La lame doit être conservée en position horizontale pour empêcher la migration des grains de pollen vers le bord de la lamelle.
Afin d’avoir une bonne résolution optique, il est conseillé d’utiliser des lames de microscope d’une épaisseur entre 0.93 et 1.05 mm. De même, la lamelle doit avoir une épaisseur comprise entre 0.13 et 0.19 mm. Lame et lamelle doivent être en verre et nettoyées avec de l’alcool à 95 % avant utilisation.
Cette technique est simple et permet d’observer les grains de pollen rapidement. Elle est utile pour l’observation de pollens à membrane fragile ou pour observer des caractéristiques qui ne sont pas visibles avec d’autres techniques (Betula sp.). Néanmoins, les grains de pollen seront simplement dégraissés en surface par l’alcool, mais ils ne seront pas vidés de leur contenu. Certaines caractéristiques telles que les ornementations sur la surface de l’exine seront difficiles à observer. Il existe une autre technique, très utilisée en Paléobotanique, mise au point et préconisée par G. Erdtman (1942) qui consiste à traiter l’échantillon avec de l’acide acétique (CH3COOH) pour le déshydrater, puis ensuite avec un mélange d’acide sulfurique (une part) et d’acide acétique anhydre (anhydride acétique (CH3CO)2 O) (neuf parts) en bain Marie à 100 °C pendant quelques minutes. Cette réaction qui se nomme « acétolyse », permet d’éliminer le cytoplasme et de bien nettoyer la surface de l’exine. De cette manière, le grain de pollen est vidé de son contenu, ce qui permet de voir les caractéristiques de la surface de l’exine plus clairement. Etant donné qu’il faut faire des préparations avec des acides, il faut absolument travailler sous hotte et être bien protégé (gants, lunettes, blouse). La préparation peut également être colorée, notamment à la safranine, colorant qui rend les grains de pollen rose et qui permet d’obtenir un bon contraste en microphotographie. Cette méthode permet de conserver durablement les pollens.
Certains pollens sont fragiles et ne supportent pas l’acétolyse (Cannaceae, Lauraceae, Musaceae, Thurniaceae…).
Bui Thi Mai et M. Girard (CEPAM - CNRS, Nice) ont développé et validé une méthode qui utilise un mélange moins agressif constitué des mêmes ingrédients que ceux employés par Erdtman avec une proportion plus réduite d’anhydride acétique remplacé par de l’acide acétique. Cette technique permet l’observation de pollens fragiles. Aucune déformation des grains de pollens a été observée en utilisant cette technique. En plus, elle a l’avantage d’éviter le jaunissement voire le noircissement des grains. Restés incolores, ils sont ensuite colorés à la safranine. Le lutage est réalisé avec de la paraffine liquide mise en anneau ouvert sur la lame de verre. La paraffine se fige et on dépose ensuite la goutte de pollen coloré au centre. Le passage par la platine chauffante fait fondre la paraffine qui réalise alors un lut bien étanche.
Bibliographie
- Erdtman, G. 1942. An introduction to Pollen Analysis. Ronald Press Company. 239 pages.
- Faegri, K. Iversen, J. 1989. Textbook of Pollen Analysis. Fourth edition. Alden press, London.
- Jones, G. 2012. Pollen analyses for pollination research, Unacetolysed pollen. Journal of Pollination Ecology 9 (13) : 96-107.
- Jones, G. 2014. Pollen analyses for pollination research, Acetolysis. Journal of pollination Ecology 13 (21) : 203-217.