
Les fongicides et bactéricides occupent une place importante dans le monde des pesticides. Selon Eurostat, en 2016, ils représentaient 46 % des volumes de vente des produits pesticides dans 20 pays membres (Fig. 1). La France occupait la troisième place (31.910 tonnes) derrière l’Espagne (38.905t.) et l’Italie (37.047 t.). La Belgique arrivait en 8e position (2848 t.).
Selon le FRAC (Fungicide Resistance Action Committee) les fongicides recouvrent des molécules chimiques qui peuvent avoir des modes d’action très variés et peuvent agir sur : le métabolisme de l’acide nucléique, le cytosquelette et la constitution de protéines, la respiration, la synthèse des acides aminés et des protéines, la transduction des signaux, la synthèse ou le transport des lipides, l’intégrité ou le fonctionnement des membranes, la biosynthèse des stérols des membranes, des parois cellulaires et la synthèse de la mélanine dans les parois cellulaires. Ils peuvent également agir sur des sites différents. Certains fongicides ont des modes d’action inconnus et d’autres agissent sur plusieurs sites. Il existe ainsi 76 (47 + 29) codes FRAC1 a, chaque code correspondant à un type d’activité avec une cible spécifique ou multiple. Sachant cela, on peut en déduire qu’hormis le fait qu’ils détruisent les champignons, leur innocuité pour les pollinisateurs pourra varier fortement en fonction de leur matière active, de leur mode et de leur (s) site(s) d’action.
Résidus de fongicides
Vu leur présence très généralisée dans l’environnement, il est assez logique de les retrouver dans les produits de la ruche. L’examen des études qui ont analysé la présence de pesticides dans les différentes matrices apicoles confirme cette contamination assez généralisée. On peut ainsi prendre l’exemple des résultats de l’étude italienne BeeNet2 (Fig. 2)qui couvrait l’ensemble du pays. S’ ils ont mis en évidence la présence de foncigides certaines années sur les abeilles, c’est au niveau du pain d’abeille que la fréquence et les concentrations étaient les plus fortes. Sur le projet Beesyn, qui a permis d’échantillonner une centaine de ruchers en Belgique, les pesticides sont les molécules les plus retrouvées dans les matrices apicoles échantillonnées (pain d’abeille, miel et cire).

Le tableau 1 reprend les molécules les plus courantes avec leur mode d’action et leurs types d’utilisation. On peut déduire de cela que les abeilles sont réellement confrontées à ces substances.
Sachant cela, on peut s’interroger sur l’impact qu’ils peuvent avoir sur les colonies. A ce jour, nous n’avons pas trouvé de publications qui relatent des essais de terrain mettant en évidence une relation directe des phénomènes d’intoxication avec des fongicides. Par contre, l’étude réalisée en Région wallonne « Approche expérimentale des mortalités inexpliquées de colonies d‘abeilles en Wallonie »3 met en évidence que l’on retrouve plus de fongicides dans les colonies présentant des signes de dépérissement que dans les colonies sans signes (Fig. 3).
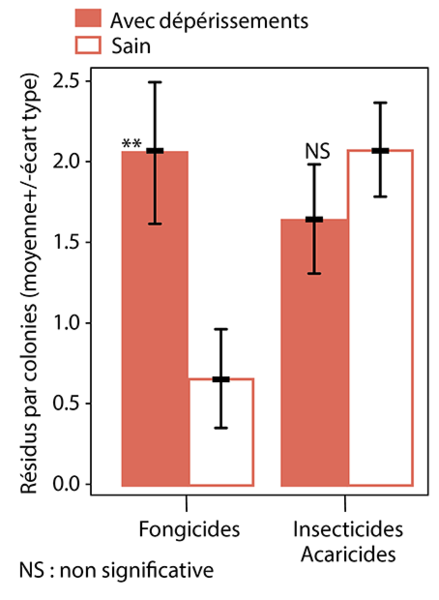
Cela peut être lié à un effet direct des fongicides. On les retrouve du fait de leur dynamique de dégradation plus lente dans l’environnement. Les dépérissements avaient également été liés à la
présence d’un environnement de cultures. Cette étude mettait également en évidence la liaison entre les surfaces de culture à proximité des ruchers et la probabilité de dépérissement. Un travail de l’USDA-ARS Honey Bee Breading, Genetic and Physiology lab de Baton Rouge4 a mis en évidence que la présence de fongicides dans le pain d’abeilles était lié à des dépérissements et cela à différentes périodes de l’année (fig. 4).
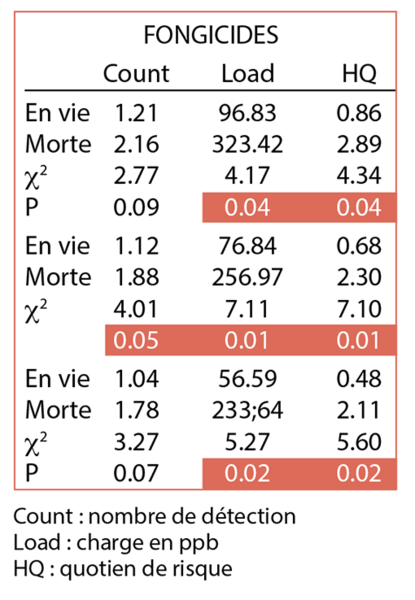
Par ailleurs, on constate qu’une période chaude et sèche en 2018 a été suivie d’un hiver à faible mortalité. On sait qu’à ces périodes estivales, les abeilles récoltent le pollen nécessaire pour l’hivernage des abeilles et que la quantité de fongicides utilisée est plus faible que lors des années plus froides et humides. Les Luxembourgeois ont également montré que des conditions en juillet relativement froides (17.2 ± 1.4 °C température moyenne du mois) et humides (110.8 ± 55.5 mm/mois) ont été associées à des pertes plus importantes au Luxembourg5.
Fongicides toxiques
Au vu de ces éléments, existe-t-il des recherches qui mettent en évidence une liaison directe entre les fongicides et des effets toxiques sur les abeilles ? Voici quelques publications qui mettent en évidence des effets toxiques directement liés à certains fongicides.
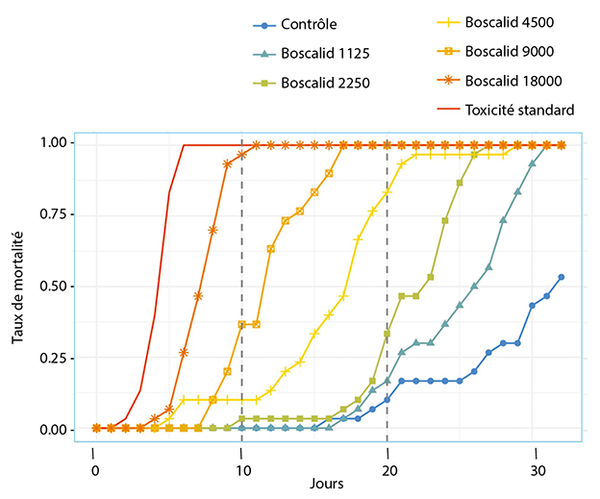
La première6 met clairement en évidence un effet du Boscalid sur la durée de vie des abeilles. Si, durant les dix premiers jours de l’intoxication, aucun effet ne peut être observé, après une quinzaine de jours, la durée de vie des abeilles soumises au Boscalid à des doses allant de 1250 à 4500 ppb se réduit rapidement comparativement aux abeilles témoins (Fig. 5). Il faut savoir que le Boscalid appartient à la nouvelle famille des SDHI (inhibiteurs de la succinate déshydrogénase). Ces fongicides ciblent la respiration cellulaire de tous les organismes vivants. L’enzyme ciblée, une fois bloquée, conduit à l‘accumulation d‘une petite molécule, le succinate, qui impacte directement l‘épigénome. Une enzyme SDH défectueuse, même partiellement, conduit à des changements métaboliques profonds et à des modifications épigénétiques (hyperméthylation des histones et de l‘ADN), à l‘origine des pathologies. La toxicité n’est pas immédiate.
Ces contaminants ne sont pas génotoxiques (n’induisent pas de mutations) et ne tuent pas les cellules. Ainsi, selon ces critères, les agences d‘évaluation ne les estiment pas toxiques pour l‘être humain et l‘environnement. Certains alertent cependant l’opinion publique pour qu’une réelle évaluation soit réalisée.
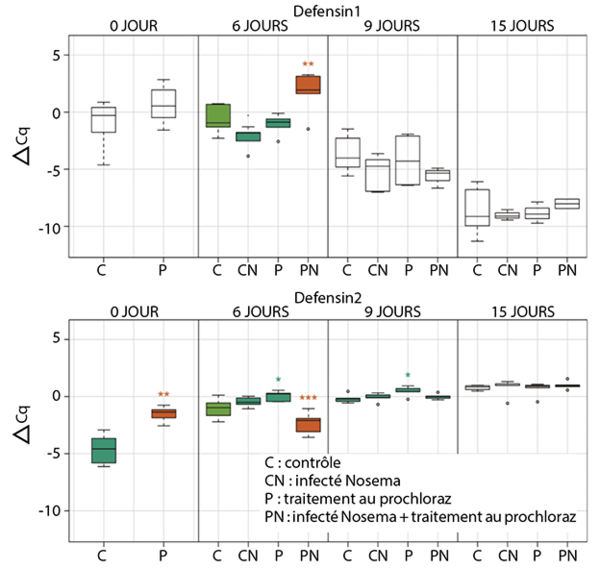
Une étude7 portant sur l’alimentation consommée par les larves contaminées par le prochloraz (fongicide à base d’imidazole qui peut altérer les gènes d’immunités des abeilles à différents stades de développement) peut présenter un danger pour le développement de l’immunité et les mécanismes de détoxification des abeilles (Fig. 6).
Une troisième étude8 a porté sur les effets sublétaux de l‘exposition au chlorothalonil sur l‘immunité, la nutrition et le développement des abeilles (Fig. 7). Elle a ainsi mis en évidence des effets sur :
- 1 la résistance et/ou la tolérance à l‘infection virale des abeilles en diminuant la survie des abeilles à la suite d‘un défi viral ;
- 2 l‘immunité sociale, en augmentant le niveau d‘activité de la glucose oxydase ;
- 3 la nutrition, en réduisant les niveaux totaux des glucides et protéines ;
- 4 le développement, en réduisant le poids total, la largeur de tête, la longueur des ailes et du corps des abeilles adultes nourrices et butineuses.
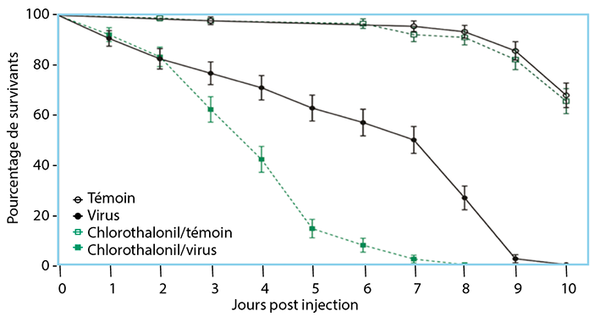 Fig. 7 - Effet de l‘exposition au chlorothalonil sur la survie des abeilles suite à une infection virale
Fig. 7 - Effet de l‘exposition au chlorothalonil sur la survie des abeilles suite à une infection virale
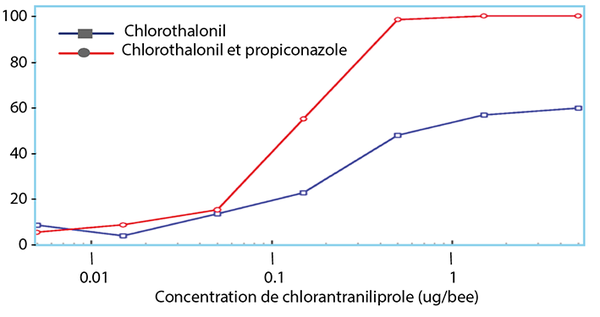
Des effets de synergie avec des pesticides peuvent également être observés. Ainsi une toxicité combinée a été notée entre le fongicide propiconazole et l’insecticide chlorantraniliprole aux doses utilisées dans les vergers d’amandiers en Californie9 (Fig. 8).
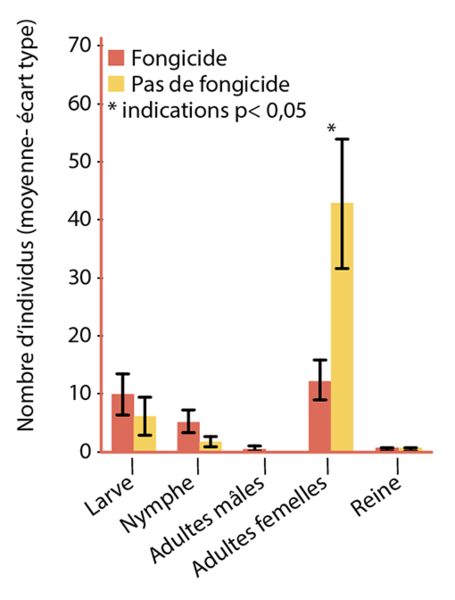
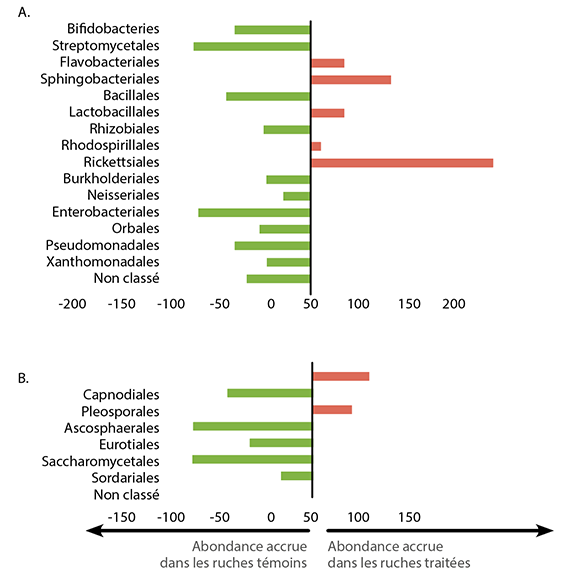
Des effets ont également été démontrés sur les colonies de bourdons10 (Fig. 9). En un mois, des résidus de fongicides génèrent un déclin des colonies de bourdons en cages d’expérimentation.
Grâce à l‘utilisation d‘outils moléculaires puissants, la complexité écologique du microbiome du pollen peut être mieux résolue. Une pléthore de bactéries et de champignons d‘origine naturelle contribuent collectivement au maintien de la forme physique de la colonie. En particulier, les levures qui ont été isolées à partir de pollens sont connues pour avoir des propriétés bactéricides et fermentescibles, toutes deux essentielles pour le développement des larves d‘abeilles. De telles associations écologiques suggèrent un degré élevé de mutualisme entre les abeilles et le microbiome du pollen. En l‘absence de ces symbiotes clés, l‘approvisionnement en pollen semble être compromis à des degrés inconnus.
En résumé, on peut dire que certains fongicides peuvent avoir un effet :
- sur l’alimentation des abeilles,
- sur la durée de vie des abeilles,
- sur le développement des populations de bourdons,
- sur le système immunitaire avec une synergie avec des agents pathogènes et, ou des pesticides.
On peut donc supposer que certains fongicides peuvent être impliqués dans des phénomènes de dépérissement.
Malheureusement, les tests en laboratoire actuels ne permettent pas de mettre en évidence de tels effets et il est dès lors indispensable de pouvoir mettre en évidence les effets toxiques retardés potentiels de certains fongicides. Il faut donc revoir la durée actuelle des tests afin de pouvoir analyser la durée de vie totale des abeilles. Des tests liés à l’alimentation et à la digestibilité du pollen soumis aux fongicides sont indispensables.
Cela demandera une amélioration des lignes guides qui n’est pas encore approuvé dans sa forme actuelle.
Bibliographie
- 1. Anonyme – 2018 - FRAC Code List 2018
- 2. Lodesani M. et al. – 2016 - Beenet : national-wide monitoring project in Italy – conférence Beecome 2016
- 3. Simon-Delso N. et al – 2014 - Honeybee colony disorder in crop areas : the role of pesticides and viruses DOI : 10.1371/journal.pone.0103073
- 4. Rinkevich F. – 2019 - Heterogeneous Pesticide Exposure and Variation in Mechanism and Rate of Honey Bee Colony Losses. Poster USDA-ARS Honey Bee Breeding, Genetics and Physiology Lab
- 5. Beyer et al. – 2018 – Winter honey bee colony losses, Varroa destructor control strategies, and the role of weather conditions : results from a survey among beekeepers. - Res Vet Sci. 2018 Jun ; 118 : 52-60
- 6. Simon-Delso N. – 2018 - Time-to-death approach to reveal chronic and cumulative toxicity of a fungicide for honeybees not revealed with the standard ten-day test - Scientific Reports volume 8, Article number : 7241 (2018)
- 7. Glavinic U. et al. – 2018 - Response of adult honey bees treated in larval stage with prochloraz to infection with Nosema ceranae - PeerJ, DOI 10.7717/peerj.6325
- 8. O’Neal S. et al. – 2019 - Chlorothalonil Exposure Alters Virus Susceptibility and Markers of Immunity, Nutrition, and Development in Honey Bees - Journal of Insect Science, (2019) 19(3) : 14 ; 1–8
- 9. Wade A. – 2019 - Combined Toxicity of Insecticides and Fungicides Applied to California Almond Orchards to Honey Bee Larvae and Adults - Insects 2019, 10, 20
- 10. Steffan S. et al. – 2017 - Empirical, Metagenomic, and Computational Techniques Illuminate the Mechanisms by which Fungicides Compromise Bee Health - Journal of Visualized Experiments October 2017 : 128 : P12
