L’ectoparasite des abeilles, Varroa destructor, est considéré comme un acteur principal dans l’effondrement des colonies d’abeilles mellifères à travers le monde. Originaire d’Asie, le varroa a quitté son hôte primitif asiatique Apis cerana au siècle dernier, pour parasiter sa cousine, Apis mellifera, qui est l’espèce d’abeille majoritairement présente à la surface du globe. Il a ensuite très rapidement colonisé l’ensemble des continents si bien qu’il est aujourd’hui présent partout sauf en Australie ou dans des colonies très isolées de Suède et de Norvège. Le varroa se nourrit de l’hémolymphe des abeilles mais c’est aussi un vecteur de plusieurs virus, comme le virus des ailes déformées. Ainsi, cet acarien réduit la longévité, l’immunité et les capacités reproductrices et locomotrices de ses hôtes.
Face à ce parasite, deux stratégies étaient possibles : utiliser des acarides pour tenter d‘éliminer le problème, ou se pencher sur les mécanismes développés au cours de l‘évolution naturelle par Apis cerana, qui a appris à vivre avec cet acarien. La majorité des apiculteurs a choisi d’utiliser des acaricides, mais actuellement ces traitements ne sont plus aussi efficaces qu’avant ; le varroa devient progressivement résistant à ces produits. De plus, des traces de ces substances sont retrouvées dans les produits apicoles comme le miel, la cire et la propolis.
Des chercheurs ont observé que sur l’île de Gotland, en Suède, des colonies d’abeilles abandonnées pendant 10 ans et non traitées ont entrainé l‘apparition et la sélection de souches spontanément résistantes au varroa. Par la suite, plusieurs autres colonies naturellement résistantes ont été découvertes en d’autres endroits du monde ; citons les exemples d‘Arnot Forest dans l‘état de New York aux Etats-Unis, de Primorksy en Russie et celui d‘Avignon en France. L’étude de ces colonies a montré qu’elles présentaient trois caractéristiques communes entre elles, et également présentes chez Apis cerana : (1) un comportement de toilettage bien développé et efficace, (2) un comportement d’hygiène particulier et (3) la capacité d’inhiber la reproduction des acariens dans le couvain de la ruche.
L‘objectif de cet article est de présenter, développer et illustrer ces traits de caractères particuliers, et expliquer en quoi ils confèrent une résistance aux abeilles.
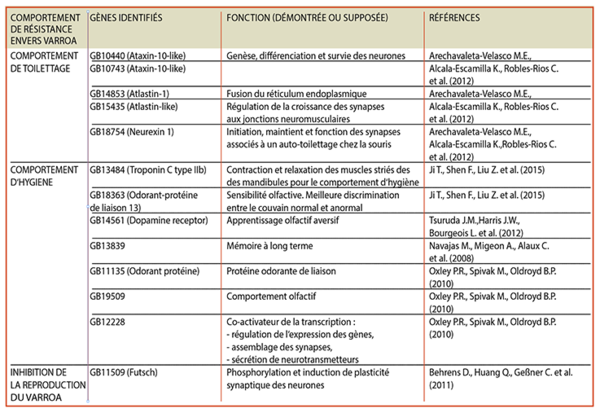
Le premier facteur de résistance est le comportement dit « de toillettage » (grooming behaviour) que les abeilles pratiquent sur elles-mêmes (auto-grooming) ou sur un congénère (allo-grooming). Ce trait de caractère a une héritabilité (encadré) de 0.71. En 2012, des chercheurs ont identifié plusieurs gènes ayant un impact sur ce comportement (tableau).
L‘héritabilité
L‘héritabilité (h2) est une valeur statistique qui évalue la part du phénotype qui est due à la génétique. Elle correspond au rapport de la variance génétique sur la variance phénotypique. Le phénotype correspond à l‘aspect extérieur d‘un individu ; il peut être influencé par différentes composantes comme l‘environnement ou la génétique. L’héritabilité d’un trait a donc une valeur comprise entre 0 et 1. Si h2 est supérieur à 0,25, cela signifie que la composante génétique a une grande influence sur le phénotype. Il est dès lors intéressant de sélectionner ce trait dans les programmes d’élevage.
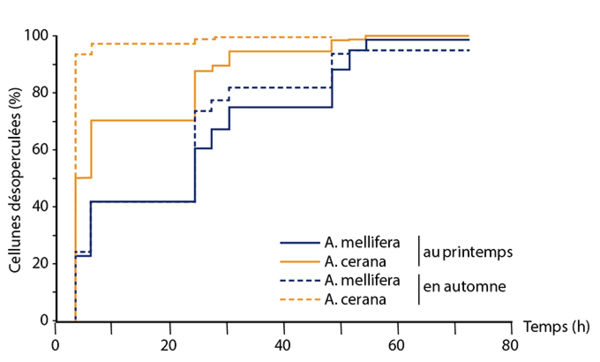
Le deuxième mécanisme d’intérêt est le comportement hygiénique (hygienic behaviour) ; il est composé de deux parties. Dans un premier temps, les abeilles détectent les cellules de couvain infectées par le varroa et enlèvent l’opercule de cire de ces cellules - qui libèrent des doses de phéromones plus importantes que les cellules de couvain saines. Dans un deuxième temps, les abeilles sortent la pupe infectée par les varroas en croissance et la jettent hors de la ruche. Les abeilles capables de repérer le couvain infecté possèdent le « Varroa Sensitive Hygiene trait » (VSH). Ce comportement a une héritabilité de 0.65 et différents gènes ont été reliés à ce comportement (tableau), notamment un gène codant pour la troponine - une protéine impliquée dans la contraction des muscles striés, utile pour le mouvement des mandibules lorsque les abeilles désoperculent la cellule de couvain et extirpent la pupe infectée. D’autres gènes impliqués dans l’odorat des abeilles ont aussi été reliés à ce comportement. En effet, il a été montré que les hôtes primitifs du varroa, les abeilles Apis cerana, ont des capacités olfactives meilleures que Apis mellifera. Comme le montre la figure 1, les abeilles asiatiques sont deux fois plus rapides pour enlever l’opercule de cire que les abeilles.
Ceci s’explique par le fait qu’elles possèdent plus de récepteurs olfactifs et expriment plus de protéines de l‘olfaction que Apis mellifera.
Résistance ou tolérance au Varroa ?
Le terme « résistance » renvoie à la capacité de l’hôte à limiter le fitness (qui correspond au taux de survie multiplié par la fécondité) du parasite, alors que la tolérance est définie comme la capacité de l’hôte à s’adapter pour limiter les dégâts du parasite. Ainsi, le comportement de toilettage et le comportement d’hygiène sont plutôt des mécanismes de tolérance. Seule l’inhibition de la reproduction du varroa est véritablement un mécanisme de résistance.
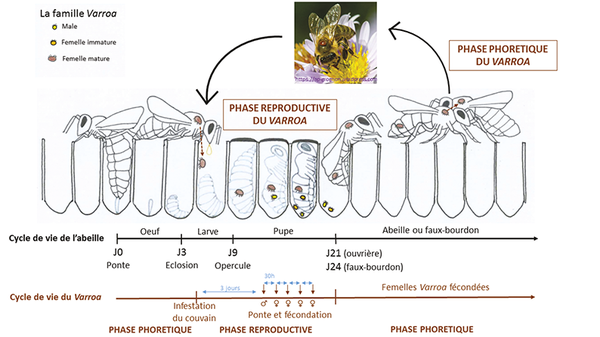
Le dernier facteur de résistance est l’inhibition de la reproduction du varroa. En effet, le cycle de vie du Varroa destructor est extrêmement lié au cycle de vie de l’abeille. Comme l’illustre la figure 2, les femelles varroa se trouvent soit sur les abeilles adultes, pendant la phase phorétique (durant laquelle l’acarien se nourrit de l’hémolymphe de son hôte et en profite aussi pour se propager à d’autres ruches), soit dans les cellules de couvain pour leur phase reproductrice. Les varroas mâles, eux, ne sont présents que dans les cellules de couvain car leur rostre piqueur n’est pas sclérotisé, ils ne peuvent donc pas percer la cuticule des abeilles adultes pour se nourrir de leur hémolymphe. Dans la cellule de couvain, la femelle varroa précédemment fécondée pond des œufs, qui éclosent et se développent en 7 jours pour donner un unique jeune mâle et plusieurs jeunes femelles. Le mâle s’accouple avec ses sœurs, qui sont donc fécondées avant de sortir de la cellule de couvain, accrochées à l’abeille qui a fini sa pupaison.
L’inhibition de la reproduction du varroa constitue donc une stratégie pour combattre le parasite, en retardant la ponte des œufs de la femelle adulte ou en induisant la mort des jeunes varroas formés. L’héritabilité de ce trait est estimée à 0.46, et plusieurs gènes ont été identifiés comme potentiellement responsables de ce trait (tableau). Il s‘agit bien ici d‘une propriété de résistance (encadré).
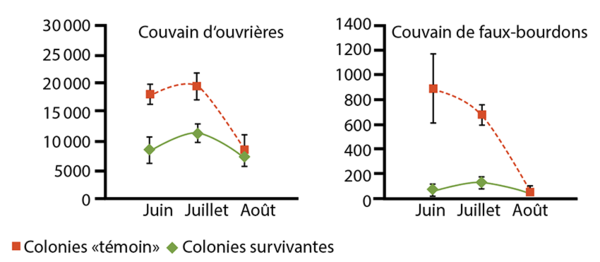
On a remarqué que les colonies d’abeilles résistantes au varroa ne sont pas de grande taille, mais au contraire, comptent peu d’individus (figure 3). En effet, s’il y a peu d’abeilles dans une colonie, cela signifie qu‘il y a peu de cellules de couvain disponibles pour la reproduction du varroa. Ceci entraine une moindre densité de varroas dans la ruche.
Conclusion
Sélectionner des abeilles résistantes au varroa est donc possible. Depuis les années 80, les programmes d’élevage se concentrent sur ces trois comportements de résistance, considérés comme les principales stratégies de défense contre le varroa ; ils permettent en effet à ces ruches de garder un taux de parasites stable et tolérable dans la ruche, si bien que ces colonies d‘abeilles peuvent se passer de traitements. Les programmes d’élevage s’assurent aussi que les abeilles ainsi sélectionnées conservent une productivité intéressante et ne soient pas agressives envers l’homme. En Amérique du Nord, il existe plusieurs programmes d’élevage et il est possible d’acheter des reines VSH. En Europe, il y a aussi des nombreux programmes d’élevages, à petite échelle, dirigés par des apiculteurs et soutenus par des institutions gouvernementales.
Il faut plusieurs années pour développer une souche d’abeille parfaitement résistante, mais cette sélection très poussée réduit la variabilité génétique des colonies. Ces abeilles sont bien moins rustiques que les abeilles « naturelles », et elle pourrait ne pas être capables de survivre à une nouvelle maladie ou à un autre parasite dans les années à venir. Ainsi, la meilleure solution est peut-être d’attendre que la nature évolue, et de laisser le temps à nos abeilles de développer leur propre résistance, comme l’a très bien fait Apis cerana.
Bibliographie :
- Arechavaleta-Velasco M.E., Alcala-Escamilla K., Robles-Rios C., Tsuruda J.M., Hunt G.J.(2012). Fine-scale linkage mapping reveals a small set of candidate genes influencing honey bee grooming behavior in response to Varroa mites. PLoS ONE 7(11) : e47269. doi : 10.1371/journal.pone.0047269.
- Behrens D., Huang Q., Geßner C., Rosenkranz P., Frey E., Locke B., Moritz R.F.A., Kraus F.B.(2011). Three QTL in the honey bee Apis mellifera L. suppress reproduction of the parasitic mite Varroa destructor. Ecology and Evolution 1(4) : 451-458.
- Boecking O., Bienefeld K., Drescher W. (2000). Heritability of the Varroa-specific hygienic behaviour in honey bees (Hymenoptera : Apidae). Journal of Animal Breeding and Genetics 117, 417-424.
- Duay P., De Jong D., Engels W. (2002). Decreased flight performance and sperm production in drones of the honey bee (Apis mellifera) slightly infested by Varroa destructor mite during pupal development. Genetics and Molecular Research 1(3), 227-232.
- Ji T., Shen F., Liu Z., Yin L., Shen J., Liang Q., Luo Y.X.(2015). Comparative proteomic analysis reveals mite (Varroa destructor) resistance-related proteins in Eastern honeybees (Apis cerana). Genetics and Molecular Research 14(3) : 10103-10118.
- Jung J.W., Park K.W., Oh H., Kwon H.W.(2014). Structural and functional differences in the antennal olfactory system of worker honey bees of Apis mellifera and Apis cerana. Journal of Asia-Pacific Entomology 17, 639-646.
- Lin Z., Page P., Li L., Qin Y, Zhang Y., Hu F., Neumann P., Zheng H., Dietemann V. (2016). Go East for better honey bee health : Apis cerana is faster at hygienic behavior than Apis mellifera. PloS ONE 11 (9) : e0162647.
- doi:10.1371/journal.pone.0162647.
- Locke B. (2016). Natural Varroa mite-surviving Apis mellifera honeybee populations. Apidologie 47, 467-482.
- Locke B., Forsgren E., De Miranda J.R.(2014). Increased tolerance and resistance to virus infections : A possible factor in the survival of Varroa destructor-resistant honey bees (Apis mellifera). PLoS ONE 9(6) : e99998. doi:10.1371/journal.pone.0099998.
- Locke B., Fries I. (2011). Characteristics of honey bee colonies (Apis mellifera) in Sweden surviving Varroa destructor infestation. Apidologie 42, 533-542.
- Oxley P.R., Spivak M., Oldroyd B.P.(2010). Six quantitative trait loci influence task thresholds for hygienic behaviour in honeybees (Apis mellifera). Molecular Ecology 19, 1452-1461.
- Rosenkranz P., Aumeier P., Zielgelmann B. (2010). Biology and control of Varroa destructor. Journal of Invertebrate Pathology 103, S96-199.
- Tsuruda J.M., Harris J.W., Bourgeois L., Danka R.G., Hunt G.J.(2012). High-resolution linkage analyses to identify genes that influence Varroa sensitive hygiene behavior in honey bees. PLoS ONE 7(11) : e48276. doi:10.1371/journal.pone.0048276.
