L’immunité sociale chez les abeilles
Apparue il y a une cinquantaine de millions d‘années (Michener et Grimaldi, 1988) les abeilles ont évolué avec leur environnement et se sont adaptées à diverses menaces biologiques. Pour se protéger des virus, bactéries, champignons et autres parasites, au niveau individuel, les abeilles de la colonie se protègent par le biais de cellules immunitaires circulant dans l’hémolymphe. Cette réponse immunitaire est en revanche relativement peu développée en regard d’autres espèces non sociales. La colonie d’abeille peut en effet être considérée comme un superorganisme dont l’immunité principale est dite « sociale » c’est-à-dire liée à l’organisation de la colonie (Cremer et al, 2003).
Les colonies abritent 15.000 à 80.000 individus organisés en différentes castes (reines, mâles et ouvrières) ayant chacune une fonction précise à jouer dans la survie de la colonie. Tandis que les reines et mâles assurent la transmission de leur patrimoine génétique à leur descendance, les ouvrières se partagent une multitude de tâche en fonction de leur âge, de leur génétique et des interactions avec leurs congénères. La santé de la colonie nous le verrons, passe par tout un ensemble de comportements et de stratégies mis en place par ce super organisme.
La propolis, une barrière contre les microbes
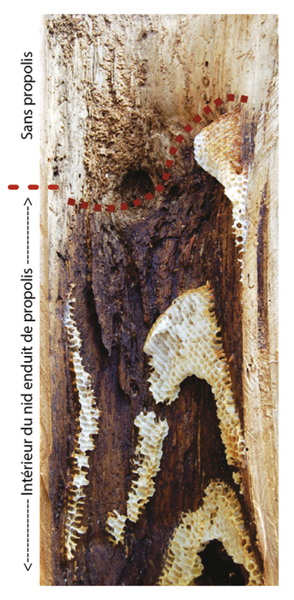
La propolis désigne la résine collectée sur certaines espèces végétales, transformée par les abeilles et ramenée à l’intérieur du nid. Les abeilles des climats tempérés collectent cette résine principalement sur les troncs ou les feuilles des arbres (peupliers, hêtres, pins …) et la chargent sur leurs pattes postérieures au niveau de leur corbicula (corbeille à pollen) pour la ramener au nid. Cette substance a de multiples fonctions. Enduite à l’intérieur des cavités creuses des arbres, des interstices et de l’entrée du nid elle permet de constituer une barrière contre les microbes pathogènes et de protéger la colonie (Seeley and Morse, 1976). Elle est utilisée par les ouvrières pour désinfecter le fond des alvéoles avant que la reine n’y ponde un nouvel oeuf. Or, dans les ruches, la propolis utilisée par les abeilles domestiques joue un rôle tout aussi important. On retrouve cette même substance sur les parois à l’intérieur du corps de ruche et dans les interstices du corps de ruche où elle permet de lutter contre l’intrusion de microbes et sert également à maintenir une étanchéité (Simone-Finstrom et Spivak, 2010). De surcroit une étude a montré que la viabilité du couvain et l’espérance de vie des ouvrières était significativement améliorée dans les colonies produisant de plus grandes quantités de propolis (Nicodemo et al, 2014).
La régulation du climat dans le nid d’abeilles
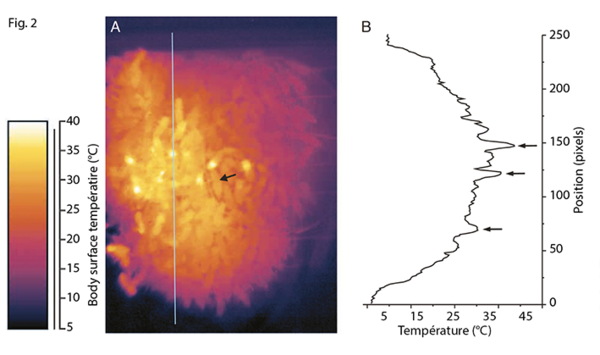
La régulation de la température et des conditions d‘humidité sont cruciales pour la colonie, son couvain et la régulation de son cycle biologique. Ce dernier, situé au centre de la grappe a en effet besoin d’une température idéale de 35°C pour pouvoir se développer correctement. Ainsi les abeilles parviennent à garder une température assez élevée en se pressant autour du couvain et en faisant vibrer leur muscles thoraciques. Ceci a pour effet respectivement d’éviter les déperditions de chaleur et d’augmenter la production de chaleur (Moritz, and Southwick). Lorsque les températures extérieures augmentent dangereusement les abeilles peuvent accentuer les pertes caloriques en ventilant la ruche et en augmentant l’apport d’eau (Seeley and Heinrich, 1981). Ces deux comportements sont également très importants pour réguler l’humidité à l’intérieur de la ruche.
Cette thermorégulation est dépendante des interactions entre les différentes classes d’abeilles et il a été montré que la diversité génétique dans la colonie augmentait l’efficacité de ce processus (Jones et al, 2004).
La régulation de la température peut également être utilisée comme mécanisme de défense contre des pathogènes. Ainsi des cas de fièvre induite par les abeilles afin de tuer des couvains infectés par Ascosphaera apis ont été reportés (Starks et al., 2000). Il est intéressant de noter que d’autres espèces d‘abeilles ont co-évolué avec la menace de prédateurs tels que le frelon asiatique Vespa velutina. Ces individus sont capables de tuer des frelons en les entourant et en formant des « boules thermiques » (Ken et al., 2005 ; Arca et al., 2014), la proximité des abeilles asphyxiant et cuisant littéralement le frelon.
L’Hygiène des abeilles

Les abeilles adoptent tout d’abord des comportements hygiéniques visant à éliminer les agents pathogènes. Elles se débarrassent individuellement des poussières et parasites attachés à leur corps en utilisant leur première et troisième paire de pattes. Certaines ouvrières vont également se spécialiser dans l’épouillage de leurs congénères (ou allo-nettoyage) tandis que d’autres abeilles dites nettoyeuses ôtent les individus morts (Visscher, 1983). Chez certaines colonies, un comportement hygiénique spécifique permettant de réguler le nombre de varroas chez Apis mellifera a été identifié, il s’agit du comportement « Varroa sensitive hygiène ». Lors de ce nettoyage, les abeilles identifient la présence de Varroa dans le couvain à différents stades de développement. Elles procèdent à l’ouverture de l’opercule et peuvent soit retirer le couvain infecté ou bien uniquement le Varroa (Harris 2005). Ce comportement a été observé chez des abeilles sélectionnées pour leur résistance aux varroas mais également chez des colonies sauvages où il pourrait être impliqué dans la survenue naturelle de la résistance aux varroas (Locke, 2016).

Essaimage
L’essaimage est le départ d’une reine et de la moitié de la colonie d’abeille de son foyer d’origine vers un nouveau lieu. Ce comportement a plusieurs bénéfices pour la colonie. Il permet d’éviter la surpopulation dans le nid et donc le manque de nourriture, de construire un nouveau nid plus hygiénique et également de faire baisser le taux de parasites en stoppant momentanément la ponte de la reine. Cet essaimage permet également de favoriser le brassage génétique en mettant en présence de nouvelles populations d’abeilles qui étaient éloignées géographiquement.
Un monde à découvrir...
La recherche sur l’immunité sociale des abeilles est assez récente et il n’est pas exclu que de nouveaux comportements soient découverts chez Apis mellifera. Chez des espèces d’abeilles différentes des stratégies collectives de défense supplémentaires liées à l’immunité innée ont été décrites. Ainsi chez Apis cerana le phénomène de « suicide altruiste » des ouvrières a été décrit et semblerait être lié à une meilleure résistance de la colonie aux varroas (Page et al., 2016). Le phénomène de « boule thermique » comme décrit ci-dessus. Enfin, à l‘heure actuelle très peu d’études portent sur les interactions bénéfiques entre les abeilles et d’autres organismes. Ainsi la flore microbienne spécifique transmise à travers le nourrissage des jeunes abeilles par les ouvrières pourrait-elle jouer un rôle prépondérant dans l’immunité sociale des abeilles (Kwong et Moran, 2016). Certaines de ses souches bactériennes ont en tout cas été identifiées comme capables d’activer le système immunitaire de l’abeille (Emery et al., 2017). Chez l’espèce Bombus terrestris, la flore microbienne semblerait également protéger l’insecte contre Crithidia bombi, un parasite intestinal.
Il a été montré par exemple que les abeilles du genre Megaloptera, vivent en symbiose avec des acariens qui consomment des espèces fongiques présentes dans les alvéoles (Biani et al 2009). Quant aux pseudoscorpions, par leur capacité à se nourrir de petits insectes et acariens (dont le varroa) et à être transporté par des abeilles (Poinar et al 1998) cet arachnide a fait ces dernières années l’objet d‘un certain intérêt. Ces arachnides ont été observés jusqu’à présent chez les abeilles mélipones (Gonzalez et al, 2008), Apis cerana (Thapa et al., 2015) et dans des nids d’abeilles sauvages en Asie, Afrique et Espagne (Judson. 1990). En Belgique et en Europe du Nord, leur présence dans les nids d’Apis mellifera reste encore à confirmer par les scientifiques.
Conclusion
Qu’elle soit logée dans une cavité naturelle (arbres ou autres) ou artificielle (ruche), la colonie d’abeille va mettre en place un véritable cocon dans lesquelles vont régner des conditions particulières de chaleur, d’humidité et de propreté et dans lesquelles chaque individu aura un rôle bien défini. Cet environnement va protéger les abeilles des conditions climatiques, des prédateurs et des agents pathogènes. Une perturbation majeure de leur habitat met de facto en danger la santé et la survie de la colonie. Mais heureusement les abeilles sont extrêmement résilientes et tolèrent des perturbations ponctuelles de leur habitat lors de la pratique apicole.
Bibliographie
- Michener, C. D., & Grimaldi, D. A.(1988). The oldest fossil bee : Apoid history, evolutionary stasis, and antiquity of social behavior. Proceedings of the National Academy of Sciences, 85(17), 6424–6426.
- Cremer, S., Pull, C. D., & Fürst, M. A. (2018). Social Immunity : Emergence and Evolution of Colony-Level Disease Protection. Annual Review of Entomology, 63(1), 105–123.
- Seeley, T. D., & Morse, R. A.(1976). The nest of the honey bee (Apis Mellifera L.). Insects Sociaux, Tome 23(4), 495-512.
- Simone-Finstrom, M., & Spivak, M. (2010). Propolis and bee health : the natural history and significance of resin use by honey bees. Apidologie, 41(3), 295–311.
- Nicodemo, D., Malheiros, E. B., De Jong, D., & Couto, R. H. N.(2014). Increased brood viability and longer lifespan of honeybees selected for propolis production. Apidologie, 45(2), 269–275.
- Moritz, R.F.A, Southwick, E.E.(1992) Bees as superorganisms. Springer Verlag P80-87
- Jones, J. C., Myerscough, M. R., Graham, S., & Oldroyd, B. P.(2004). Honey bee nest thermoregulation : Diversity promotes stability. Science, 305(5682), 402–404.
- Starks, P., Blackie, C., & Seeley, T. (2000). Fever in honeybee colonies. Naturwissenschaften, 87(5), 229–231.
- Ken, T., Hepburn, H. R., Radloff, S. E., Yusheng, Y., Yiqiu, L., Danyin, Z., & Neumann, P. (2005). Heat-balling wasps by honeybees. Naturwissenschaften, 92(10), 492–495.
- Arca, M., Papachristoforou, A., Mougel, F., Rortais, A., Monceau, K., Bonnard, O., … Arnold, G. (2014). Defensive behaviour of Apis mellifera against Vespa velutina in France : Testing whether European honeybees can develop an effective collective defence against a new predator. Behavioural Processes, 106, 122–129.
- Visscher, P. K.(1983). The honey bee way of death : Necrophoric behaviour in Apis mellifera colonies. Animal Behaviour, 31(4), 1070–1076.
- Harris, J. W.(2007). Bees with Varroa Sensitive Hygiene preferentially remove mite infested pupae aged ≤ five days post capping. Journal of Apicultural Research, 46 (September 2007), 134–139.
- Locke, B. (2016). Natural Varroa mite-surviving Apis mellifera honeybee populations. Apidologie, Vol. 47, pp. 467–482.
- Page, P., Lin, Z., Buawangpong, N., Zheng, H., Hu, F., Neumann, P., … Dietemann, V. (2016). Social apoptosis in honey bee superorganisms. Scientific Reports, 6(June), 10–15.
- Kwong, W. K., & Moran, N. A.(2016). Gut microbial communities of social bees. Nature Reviews Microbiology, 14(6), 374–384.
- Emery, O., Schmidt, K., & Engel, P. (2017). Immune system stimulation by the gut symbiont Frischella perrara in the honey bee (Apis mellifera). Molecular Ecology, 26(9), 2576–2590.
- Biani, N. B., Mueller, U. G., & Wcislo, W. T.(2009). Cleaner Mites : Sanitary Mutualism in the Miniature Ecosystem of Neotropical Bee Nests. The American Naturalist, 173(6), 841–847.
- Poinar Jr., G. O., Curcic, B. P. M., & Cokendolpher, J. C.(2008). Arthropod Phoresy Involving Pseudoscorpions in the Past and Present. Acta Arachnologica, 47(2), 79–96. https://doi.org/10.2476/asjaa.47.79
- Gonzalez, V. H., Mantilla, B., & Mahnert, V. (2017). A New Host Record for Dasychernes Inquilinus (Arachnida , Pseudoscorpiones , Chernetidae ), with an Overview of Pseudoscorpion-Bee Relationships. The Journal of Arachnology, 35(3), 470–474.
- Thapa, R., Wongsiri, S., Lee, M. L., & Choi, Y.-S. (2013). Predatory behaviour of pseudoscorpions (Ellingsenius indicus) associated with Himalayan Apis cerana. Journal of Apicultural Research, 52(5), 219–226.
- Judson, M. L. I.(1990). Redescription of the bee-associate Ellingsenius fulleri (Hewitt and godfrey) (arachnida, chelonethi, cheliferidae) with new records from Africa, Europe and the middle East. Journal of Natural History, 24(5), 1303–1310.
