Après avoir envisagé l’angle de la compétition alimentaire, voyons ici la question de la transmission d’agents pathogènes. L’abeille mellifère peut-elle constituer un danger pour les espèces sauvages de ce point de vue ?
A l’échelle européenne, Mallinger et al. relèvent 27 études publiées entre 1900 et 2016 sur la question de la trans mission potentielle de pathogènes des espèces gérées vers les espèces sauvages. Les espèces de bourdons comme les abeilles mellifères sont concernées par ces études.

Six études portent sur la transmission d’agents infectieux des abeilles mellifères (dans leur zone de distribution naturelle) à d’autres espèces, essentiellement des bourdons5/6 mais aussi des osmies, andrènes et hériades1/6. Publiées entre 2006 et 2015, ces publications sont relativement récentes.
Maladies émergentes et interactions entre les espèces
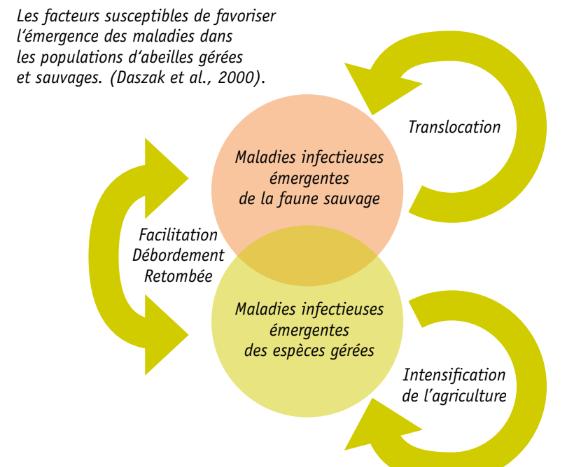
De nombreux cas de maladies infectieuses émergentes (EID) chez les animaux sauvages sont le résultat d‘interactions avec des espèces gérées. Sur base de critères épizootiologiques clés, ces maladies émergentes ont été classées en 3 catégories :
1.Les maladies associées aux débordements des animaux gérés ou domestiques sur les populations sauvages à proximité ;
2.Les maladies directement liées aux interventions humaines (concentration des élevages, importations de matériel biologique, introduction de parasites exotiques, etc.) ;
3.Les maladies sans implication des animaux gérées ou des humains.
Ces phénomènes font que de nombreuses espèces sauvages et gérées sont des réservoirs d‘agents pathogènes qui représentent une menace pour la santé animale et pour la conservation des espèces. Plus encore que dans les autres élevages, les élevages environnementaux tels que ceux des insectes pollinisateurs (abeilles mellifères ou bourdons) peuvent avoir un impact direct sur les populations sauvages avec lesquelles un contact est difficile à éviter. Le potentiel d’émergence de maladies est réel soit par transmission directe soit facilité par des changements de sensibilité de l‘hôte. Lorsque les taux de transmission intraspécifique ou interspécifique sont faibles, l‘infection peut se produire dans de nombreux cas sans que le parasite ne s‘établisse dans la population sauvage.
Y a-t-il des maladies des abeilles mellifères identifiées dans les populations sauvages ?
Une étude épidémiologique de la KU Leuven4 a identifié plusieurs pathogènes d‘abeilles mellifères chez des abeilles solitaires vivant à proximité d‘un rucher. Dans ce contexte, les résultats suggèrent que les colonies d‘abeilles mellifères représentent une source potentielle de pathogènes pour les autres pollinisateurs et les abeilles solitaires peuvent agir également comme réservoir d‘agents pathogènes de l’abeille mellifère.
Une autre étude conduite en laboratoire et sur 26 sites en Grande-Bretagne a permis à Fürst et al.5 d’identifier la prévalence du virus des ailes déformées (DWV) et de Nosema ceranae chez les populations sauvages de bourdons (Bombus spp.). Les chercheurs estiment probable que ce soit imputable aux colonies d’abeilles mellifères. Les données recueillies n’ont toutefois pas pu démontrer la direction de la transmission interspécifique du virus des ailes déformées (DWV). Le fait que les populations de bourdons (Bombus terrestris, Bombus pascuorum) présentent des déformations des ailes induites par le virus des ailes déformées qui affecte les colonies d’abeilles mellifères a été également relevé par Peter Graystock et al.6 et par Genersch et al.7
En parallèle, l’étude de Fürst et al. a mis au jour la transmission intraspécifique d‘agents pathogènes spécifiques à Bombus spp. en provenance des colonies commerciales de bourdons vers des populations de bourdons sauvages. Graystock et al. avaient aussi tiré la sonnette d’alarme en 2013 à propos8 des colonies de bourdons commerciaux importés en Grande-Bretagne. Les chercheurs avaient alors détecté la présence d’agents infectieux comme Nosema bombi, Nosema ceranae et Apicystis bombi dans les colonies de bourdons importées. Le pollen fourni avec les colonies de bourdons commerciaux contenait également des spores du parasite fongique Ascosphaera apis, responsable du couvain plâtré chez l’abeille mellifère. Les spores de ce parasite ont une longue durée de vie et se transmettent aux colonies d’abeilles en contaminant les abeilles adultes qui incorporent ensuite les spores dans l’alimentation des larves. A l’échelle mondiale, les conséquences des échanges commerciaux de bourdons pourraient avoir de sérieuses conséquences.
Des causes multifactorielles
Pour McMahon et al.9 les maladies infectieuses émergentes représentent un nouveau type de facteurs de stress pour les pollinisateurs qui s’ajoute aux modifications et à la perte de l’habitat10 et à l’impact des pesticides11. Il est plausible que ces différents facteurs agissent en synergie12. Les résultats révèlent la prévalence13 de plusieurs virus à ARN (acide ribonucléique) associés aux abeilles mellifères dans les populations d’abeilles sauvages.

Si des preuves de transmission de maladies virales entre les populations gérées et sauvages sont établies, les chercheurs se disent prudents en ce qui concerne la direction de la propagation et les espèces qui constituent le réservoir principal des maladies infectieuses, même si Apis mellifera est le suspect N°1. Ils envisagent la probabilité d’un réseau interconnecté de pressions potentielles de maladies au sein et entre les espèces de pollinisateurs. Si les virus des abeilles mellifères sont couramment détectés à de faibles niveaux chez de nombreuses espèces d‘abeilles sauvages, aucune preuve n’est établie que ces pathogènes entraînent des effets de mortalité élevés à court terme. Après inoculation expérimentale à deux espèces d‘abeilles sauvages (Megachile rotundata et Colletes inaequalis) d’un cocktail de virus mortels pour les abeilles mellifères, aucun effet sur la survie à court terme n’a été observé sur les abeilles sauvages inoculées par les chercheurs16.
Gare au butinage !
Un risque important de transmission interspécifique de parasites et d’acariens existe, en particulier lors du butinage commun sur les fleurs14. Dans une étude publiée en 2015, Graystock et al.15 ont montré que les fleurs constituent un facteur de dispersion croisée des parasites chez les pollinisateurs. Les parasites de plusieurs pollinisateurs circulent d’un hôte à l’autre à partir des fleurs sans que les espèces constituent une barrière. Les chercheurs ont trouvé principalement quatre parasites bénéficiant de cette stratégie de dispersion :
• Nosema apis et Nosema ceranae, res ponsables de la nosémose chez l’abeille mellifère.
• Crithidia bombi, parasite intestinal du bourdon terrestre qui provoque des perturbations graves dans les com portements de butinage et entraine la mort des ouvrières. Crithidia bombi semble se répandre plus facilement grâce à l’expansion de la commercia lisation des bourdons terrestres à des fins de pollinisation en serre. Le para site aurait tendance à se propager à d’autres espèces sauvages jusqu’ici pas ou peu infestées. A noter que les para sites du genre Crithidia sont des para sites très répandus chez les
arthropodes en général.
• Apicystis bombi, parasite qui infecte toutes les abeilles, y compris les abeilles mellifères, et tout spécialement les bourdons. Le parasite a été importé en Europe, probablement via le commerce des colonies de bourdons terrestres pour la pollinisation des cultures.
Les colonies de bourdons terrestres sont devenues tolérantes à cet agent pathogène mais ce n’est pas le cas des autres espèces. Le parasite provoque des changements de comportement, freine la création de colonies et provoque la mort des ouvrières.

Héberger des abeilles sauvages, une fausse bonne idée ?
Comparativement aux abeilles eusociales, les abeilles solitaires sont spécifiquement associées à un plus large éventail d‘acariens17. Observer l’activité des osmies dans les nichoirs au début du printemps permet d’être témoin de l’infestation de certains insectes par un acarien du genre Chaetodactylus18. Chae todactylus osmiae parasite osmia rufa et osmia cornuta par exemple. Une ving taine d’espèces de cet acarien sont recen sées19. Ils parasitent plusieurs familles d’abeilles sauvages : les Megachilidae, les Osmiini, les Anthidiini, les Megachilini, les Apidae, etc.
Les acariens tuent généralement les jeunes larves d‘abeilles et se nourrissent du pollen stocké dans les cellules. Dans les nids avec cloisons comme les nids d’osmies, les abeilles femelles qui se développent dans les cellules les plus profondes se frayent un chemin hors du nid. C’est à ce moment que les deu tonymphes phorétiques d’acariens20 dans les cellules ouvertes peuvent s‘attacher à elles. Les nichoirs à insectes sont de véritables foyers d’infestation puisque les acariens survivent dans les nichoirs déjà utilisés et infestent de nouveaux hôtes qui réutilisent ces nids21. La mode des hôtels à insectes n’est probablement pas sans conséquences.
Nécessité d’un contrôle accru des agents pathogènes
Les études sont majoritairement conduites par des chercheurs en biologie moléculaire qui cherchent à comprendre les risques de transmission de maladies infectieuses émergentes entre les espèces pollinisatrices gérées et sauvages. Pour ce faire, ils isolent l’ARN des virus d’Apis mellifera qui sont ensuite recherchés sur les espèces sauvages de pollinisateurs. Les méthodes actuelles de séquençage du génome permettent aisément de déterminer les séquences d‘acide nucléique qui prouvent la présence d’un virus. Cela ne permet toute fois pas de mettre en lumière le pouvoir pathogène des agents infectieux sur les organismes hôtes, les abeilles sauvages en l’occurrence. La détection des parasites ne signifie pas nécessairement qu‘ils sont des parasites infectieux qui posent un risque pour les autres abeilles. Le processus de détermination de la maladie est absent ou presque absent de ces études. Il serait souhaitable qu’elles soient complétées plus largement par des recherches épidémiologiques.
Par ailleurs, un contrôle accru des agents pathogènes chez les abeilles mellifères et les bourdons gérés est absolument nécessaire pour ne pas freiner le maintien des populations de pollinisateurs sauvages. Cet enjeu est aujourd’hui tout à fait bien compris dans le monde apicole. Les apiculteurs intègrent pleinement les mesures prophylactiques et leurs enjeux, y compris dans les ruchers écoles. Ceci devrait contribuer à minimiser les risques que font courir à la faune n’importe quelle intervention humaine, qu’il s’agisse d’élevage ou de nichoirs artificiels.
Photos Arianne Weyrich
Notes et références
1. Mallinger, R. E., Gaines-Day, H. R., & Gratton, C. (2017). Do managed bees have negative effects on wild bees ? : A systematic review of the litera ture. PLoS One, 12(12), e0189268.
2. Daszak P., Cunningham A.A., Hyatt A.D. Emerging infectious diseases of wildlife–threats to biodiversity and human health. Science. 2000 ; 287:443–449
3. Hatcher, M. J., & Dunn, A. M. (2011). Parasites in ecological communities : from interactions to ecosystems. Cambridge University Press.
4. Ravoet, J., De Smet, L., Meeus, I., Smagghe, G., Wenseleers, T., & de Graaf, D. C.(2014). Widespread occurrence of honey bee pathogens in solitary bees. Journal of Invertebrate Pathology, 122, 55-58.
5. Fürst, M. A., McMahon, D. P., Osborne, J. L., Paxton, R. J., & Brown, M. J. F.(2014). Disease associations between honeybees and bumblebees as a threat to wild pollinators. Nature, 506(7488), 364.
6. Graystock, P., Goulson, D., & Hughes, W. O. (2014). The relationship between managed bees and the prevalence of parasites in bumblebees. PeerJ, 2, e522.
7. Genersch, E., Yue, C., Fries, I., & de Miranda, J. R.(2006). Detection of deformed wing virus, a honey bee viral pathogen, in bumble bees (Bombus terrestris and Bombus pascuorum) with wing deformities. Journal of invertebrate patho logy, 91(1), 61-63.
8. Graystock, P., Yates, K., Evison, S. E., Darvill, B., Goulson, D., & Hughes, W. O.(2013). The Trojan hives : pollinator pathogens, imported and distributed in bumblebee colonies. Journal of Applied Ecology, 50(5), 1207-1215.
9. McMahon, D. P., Fürst, M. A., Caspar, J., Theo dorou, P., Brown, M. J., & Paxton, R. J.(2015). A sting in the spit : widespread cross‐infection of multiple RNA viruses across wild and managed bees. Journal of Animal Ecology, 84(3), 615-624.
10. Neumann, P., Schweiger, O. & Kunin, W.E. (2010). Global pollinator declines : trends, impacts and drivers. Trends in Ecology and Evolution, 25, 345–353.
11. Desneux, N., Decourtye, A. & Delpuech, J.M. (2007) The sublethal effects of pesticides on beneficial arthropods. Annual Review of Entomo logy, 52, 81–106.
Gill, R.J., Ramos-Rodriguez, O. & Raine, N.E. (2012) Combined pesticide exposure severely affects individual- and colony-level traits in bees. Nature, 491, 105–108.
Whitehorn, P.R., O’Connor, S., Wackers, F.L.& Goul son, D. (2012) Neonicotinoid pesticide reduces bumble bee colony growth and queen production. Science, 336, 351–352.
12. Gonzalez-Varo, J.P., Biesmeijer, J.C., Bommarco, R., Potts, S.G., Schweiger, O., Smith, H.G. et al. (2013) Combined effects of global change pressures on animal-mediated pollination. Trends in Ecology and Evolution, 28, 524–530.
13. La prévalence est le nombre de cas relevés d‘une maladie dans une population animale.
14. Dolezal, A. G., Hendrix, S. D., Scavo, N. A., Carrillo-Tripp, J., Harris, M. A., Wheelock, M. J., ... & Toth, A. L.(2016). Honey bee viruses in wild bees : viral prevalence, loads, and experimental inoculation. PloS one, 11(11), e0166190.
15. Durrer, S., & Schmid-Hempel, P. (1994). Shared use of flowers leads to horizontal pathogen transmission. Proc. R. Soc. Lond. B, 258(1353), 299-302.
16. Graystock, P., Goulson, D., & Hughes, W. O. (2015). Parasites in bloom : flowers aid dispersal and transmission of pollinator parasites within and between bee species. Proc. R. Soc. B, 282(1813), 20151371.
17. Okabe, K. (2013). Ecological characteristics of insects that affect symbiotic relationships with mites. Entomological Science, 16(4), 363-378.
18. https://insects.ummz.lsa.umich.edu/beemites/ Species_Accounts/Chaetodactylus.htm
19. http://idtools.org/id/mites/beemites/factsheet.php?name=15138
20. Stade larvaire où les acariens sont privés de pièces buccales mais peuvent s’accrocher aux
abeilles-hôtes pour se déplacer.
21. Chmielewski, W. (1993). Biology of Chaetodactylus osmiae (Duf., 1866) (Acaridae,
Chaetodactylidae)-polleneater phoretic on solitary bees (Apoidea)[solitariae]. Pszczelnicze Zeszyty Naukowe (Poland).
Fain A. (1966). Notes sur le biologie des acariens du genre Chaetodactylus et en particulier de C.Os miae, parasite des abeilles solitaires osmia rufa et o. cornuta en Belgique. Bulletin et annales de la Société Royale d’entomologie n°16
