La notion de santé va au-delà de la non-apparition de symptômes de maladies, et peut être expliquée comme le degré d’efficacité du métabolisme et des fonctions d’un être vivant, à l’échelle cellulaire et macroscopique (sociale). Si nous extrapolons ce concept aux abeilles mellifères, des colonies en bonne santé ne doivent pas montrer de symptômes de maladies, et la fonctionnalité de chaque abeille et de la colonie (sa cohésion et fonctionnement dans son intégralité) doivent rester indemnes. Pour les super organismes en étroites relations avec leur environnement, se maintenir en bonne santé peut constituer un réel défi.
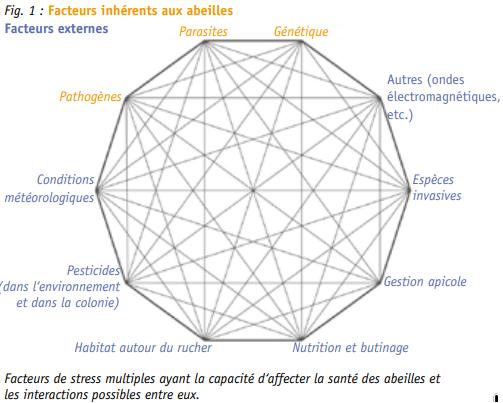
Dans cet article nous analysons quelques interactions entre les facteurs potentiels affectant la santé des abeilles. La figure ci-dessous montre graphiquement la liste des facteurs de stress pour la santé des colonies, qui sont énumérés ici :
(1) facteurs de stress inhérents aux colonies d‘abeilles : (a) infestation de colonies par des parasites comme l‘acarien Varroa destructor ou autres ; (b) virus et maladies spécifiques d‘Apis mellifera en Europe (Nosema ceranae, etc.) ; (c) perte de diversité génétique (sélection des reines) ;
(2) facteurs de stress externes aux colonies d‘abeilles : (a) anthropisation de l‘environnement (urbanisation accrue, agriculture intensive, fragmentation de l‘environnement, perte d’habitat naturel), (b) utilisation de pesticides (agissant parfois en synergie), ce qui conduit à une diminution de la biodiversité et à la pollution des ressources alimentaires des abeilles ; (c) les conditions météorologiques et l‘impact du changement climatique ; (d) les espèces invasives (le frelon asiatique (Vespa velutina) et le petit coléoptère des ruches (Aethina tumida) ; (e) la gestion apicole ; (f) d‘autres facteurs de stress mis en avant mais explorés dans une moindre mesure : ondes électromagnétiques, rayonnements, etc. La situation pour les abeilles sauvages peut ressembler à la roue de la figure 1 (en omettant la gestion apicole).
Pesticides, parasites et diversité génétique
Il est bien connu que la forme de polygamie dans laquelle la femelle (la reine) s‘accouple avec un nombre variable de mâles (de 4 à 24) est l‘une des stratégies immunitaires des abeilles mellifères. Ce faisant, il existe une diversité de sous-familles au sein de la colonie. Cette diversité permet une meilleure adaptation de la colonie en tant que population à toute situation à laquelle elle peut être confrontée (plus grand stockage de nourriture, construction de rayons et croissance de la population1). Comme d’autres, ces caractères peuvent avoir un impact sur l‘exposition poten tielle et les effets des pesticides sur la
colonie, mais aussi sur la variabilité en termes de potentiel de détoxification et de résistance aux polluants, ainsi que sur la variabilité entre différentes saisons et différentes périodes au cours d‘une même saison apicole2. Récemment, Neumann et Blacquière3 ont émis l‘hypothèse que le manque de diversité génétique déjà existant au sein des colonies d‘abeilles mellifères après des années de sélection intensive de caractères défavorables en termes de santé des abeilles, a pu amener à une réduction de leur résistance, notamment au varroa. Mal heureusement, il ne s‘agit là que de spéculations qui ne sont étayées par aucune donnée et qui doivent être prises avec précaution.
Les sous-espèces d‘abeilles peuvent aussi être un facteur de variabilité. Les abeilles mellifères des écotypes caucasica et mellifera ont montré une sensibilité à l‘imidaclopride (pesticide néonicotinoïde) plus prononcé pour la première, avec une toxicité aiguë de 14 ng/abeille et 24 ng/abeille respectivement4 (en terme de DL50 - dose qui tue 50 % des individus exposés). Dans la même ligne, A.m. caucasica semble être moins sensible aux insecticides DDT et trichlorfon qu’ A.m. ligustica et A.m. carnica5. L‘auteur n‘a observé aucun impact de la consangui-nité sur la sensibilité des abeilles aux substances toxiques (basé sur très peu de répétitions).
Pesticides, pathogènes et parasites
Les pathogènes et le parasite Varroa des tructor sont des facteurs de stress intensément recherchés. La liste actuelle de pathogènes des abeilles mellifères est présentée ci-dessous. La simple présence de ces agents n‘indique pas le déclenche ment de la maladie.
Dernièrement sur le territoire belge, un certain nombre d‘agents pathogènes connus et nouveaux ont été trouvés. Une analyse statistique fait ressortir une corrélation positive significative entre la charge en agents pathogènes et les pertes de colonies7. Ils pourraient donc avoir un impact sur la mortalité hivernale. Cependant, les éléments environnementaux (pesticides…) n’ont pas été pris en compte dans l’étude de Ravoet et al. Par conséquence il n‘est pas possible de savoir si la prolifération de ces pathogènes a causé la mort ou a été la conséquence d‘un affaiblissement causé pour d‘autres facteurs. Un analyse des pathogènes présents sur les abeilles vous donne cependant une indication sur les risques liés à la présence d’agents pathogènes. En effet, les interactions entre pesticides et pathogènes ont été décrites auparavant par d’autres auteurs. Des interactions pathogènes-toxiques ont été mises en évidence dans les années 70 entre Nosema (apis vraisemblablement) et le DDT (organochloré) ou le trichlorfon (organophosphoré)5. Les abeilles deviennent plus sensibles lorsqu‘elles sont co-exposées à des pesticides comme les néonicotinoïdes8,9,10 ou le fipronil11,12 et Nosema ceranae. Les larves élevées dans de la cire fortement contaminée sont plus sensibles à Nosema ceranae13. Des interactions entre diffé rentes familles de pesticides comme les pyréthroïdes, les organophosphorés ou les néonicotinoïdes et différents virus (CBPV14, DWV15, BQCV17), ou varroa17 ont également été décrites. Récemment une réduction du taux d‘émergence a été constatée18 lorsque les larves d‘abeilles étaient co-exposées à la loque amé ricaine (soit 4000 spores/larve ou 800 spores/larve) et au thiaméthoxame à 0,6 ng/larve (DL50 thiaméthoxame = 5 ng/abeille). De plus, l‘exposition conjointe à 400 spores de larves de loque et de thiaméthoxame au cours du développement larvaire a entraîné une réduction de la capacité d‘apprentissage à l‘âge adulte. La combinaison du dimé thoate (120 ng/abeille) ou de la clothia nidine (32 ng/larve) et des spores de larves de loque américaine a également entraîné une augmentation de la mor talité larvaire, alors que l‘effet n‘a pas été observé pour la co-exposition avec le tau-fluvalinate (480 ng/larve)19. Il est intéressant de noter que les auteurs ont également décrit un appauvrissement immunitaire des larves exposées à ces combinaisons.

Pesticides, paysage et nutrition
Sauf quelques exceptions minoritaires20 plusieurs études et observations de terrain ont montré l‘incompatibilité des monocultures industrielles avec la bonne santé des colonies bien qu’il soit difficile de considérer la culture testée comme seule source d‘exposition aux pesticides, à moins que sa surface soit suffisamment importante pour représenter l’ensemble des apports du rucher21,22,23. L‘impact
négatif de la contamination par les pesticides sur la survie des colonies et de l‘utilisation des terres/zones de culture autour des ruchers a également été décrit dans plusieurs pays (Pays-Bas24, France25, États-Unis26,27)). Des observations similaires ont déjà été décrites pour les abeilles sauvages28,29. Cependant, il existe une grande controverse autour de l‘implication des pesticides et de l‘utilisation des terres (agricoles) sur les pertes de colonies d‘abeilles inhérentes à la variabilité des conditions environnementales, à la diversité des colonies, et à la fragmentation des données sur lesquelles les résultats sont basés.
La nutrition et la recherche de nourriture, tant en quantité qu‘en qualité, sont des facteurs clés de la santé des abeilles. Ces deux éléments déterminent la productivité et le dynamisme de la colonie, l‘immunocompétence des abeilles, et assurent d‘importants processus de régulation au sein de la colonie, comme l‘élevage du couvain et la thermorégulation30,31,32,33,34. La diversité des pollens est essentielle pour façonner la physiologie de l‘abeille : les abeilles nourries avec du pollen polyfloral (quatre origines polli niques différentes) vivent plus longtemps et sont plus résistantes aux maladies35 et aux pesticides36. Les analyses palyno logiques du pollen ou du pain d‘abeille peuvent identifier la diversité du pollen apporté à la colonie et établir s‘il existe un risque de carences nutritionnelles.
Pesticides et conditions météorologiques
Le climat est déterminant pour le sort des colonies d‘abeilles mellifères car il influence la qualité et la quantité de la nourriture et des sources d‘eau pour les pollinisateurs et les possibilités de butinage pour les abeilles. Il est bien connu que les abeilles mellifères réduisent leur activité de recherche de nourriture pendant les jours de pluie et lorsque les températures sont inférieures à 12ºC. Le climat peut également déterminer le devenir d‘autres facteurs de risque comme certaines espèces envahissantes, les pathogènes ou les pesticides. Il faut savoir que dans des conditions contrôlées , la toxicité des pesticides sur les abeilles varie selon la température et l‘hygrométrie5,37,38, la toxicité de certains pesticides augmentant à des températures plus élevées (les organophosphates, les carbamates et le fipronil), tandis qu’avec d‘autres elle diminue (néonicotinoïdes, DDT et pyréthroïdes). Une toxicité de la poussière avec néonicotinoïdes est accrue avec l‘humidité relative39.
Pesticides et gestion apicole
Tenant compte de l‘état de l‘entomofaune en Europe40, il apparait que les apiculteurs font un bon travail pour maintenir la population des abeilles mellifères. La surveillance de la santé des colonies et les actions correctrices nécessaires sont naturellement une clé pour aider les colonies à se maintenir en bonne santé lorsque d’autres facteurs sont présents (le diagramme se remplit). Par contre, il faut connaître les risques pour la santé des colonies des outils que nous utilisons.
Notre savoir faire doit intégrer notre décision d‘utiliser des pratiques zootechniques quand il faut et comme il faut. Nous utilisons des produits vétérinaires pour maintenir le niveau d‘infestation de varroa sous un seuil préoccupant. Dans certaines régions du monde, les anti biotiques sont autorisés pour contrô ler les microsporidies et les loques. Les acaricides et antibiotiques synthétiques laissent des résidus dans les matrices d‘abeilles, notamment dans la cire. Des nombreuses études ont montré les effets néfastes de l‘exposition ou la co-expo sition aux résidus d‘acaricides comme le tau-fluvalinate, le coumaphos, le fenpy roximate, l’amitraz et d‘autres insecti cides, fongicides ou herbicides sur les larves, les reines et les ouvrières41,42.
Conscients de ces interactions et de la prévalence des pathogènes dans la cire d‘abeille, les apiculteurs savent qu‘ils doivent changer les cadres de corps au moins une fois tous les cinq ans43. Ces rayons sont ensuite retirés du circuit de la cire. Il faut aussi être attentif à la qualité de la cire du commerce, car il n‘y a pas de normes de qualité établies par rapport à la teneur de résidus de pesticides, ou de spores de pathogènes.
Espèces invasives
Récemment deux espèces invasives, le frelon asiatique, Vespa velutina, et le petit coléoptère de la ruche, Aethina tumida, sont venues augmenter le stress mis sur les colonies. Ainsi, les mesures de surveillance et contrôle proposées, laissées sans div class="encadre"><pment, peuvent conduire à des problèmes d‘intoxications, car parfois des pesticides très toxiques sont utilisés dans le cadre de la destruction de nids, de la surveillance, ou de la désinsectisation du sol.
Vers une approche multifactorielle
Aujourd’hui, il est difficile, et peut-être dénué de sens, d‘identifier la cause principale des pertes de colonies dans le monde entier. La prévalence des para mètres susceptibles d‘affecter la santé des colonies d‘abeilles mellifères et leurs interactions diffèrent selon les endroits44. On peut cependant considérer qu’un « réseau de causes » (causal web) détermine le destin d’une colonie45. Des chercheurs ont ainsi proposé le modèle « camembert46 », qui implique une combinaison de plusieurs causes constitutives. Selon ce modèle, les pertes de colonies ne se produiraient que lorsque le camembert est complet. Par exemple, une combinaison de parasites, de pesticides et de carences alimentaires expliquerait les déclins d‘abeilles observés récemment47. Dans cette logique, plusieurs modèles mathématiques visent à prédire l‘impact des combinaisons de plusieurs facteurs sur la santé des abeilles48,49,50.
Malheureusement, cette approche multifactorielle nécessite énormément de données et sur le terrain, il n‘existe pratiquement jamais d‘ensemble de données intégrant tous les paramètres pertinents. Cette approche mutifactorielle est de plus en plus appli quée dans la recherche apicole. Ainsi, le projet BeeSyn lancé début 2018 en Belgique pour comprendre le rôle des contaminants sur la santé des colonies, prend en compte cette logique mul ti-stress et l‘origine de ces contaminants. Les chercheurs du CRA-W et de l‘Univer sité de Gand coordonnés par le CARI collaborent dans cette initiative. Elle commence par une campagne de monitoring auprès des ruchers situés dans des communes à bas et à haut risque de pertes hivernales (Fig. 1) ; ces niveaux de risque ont été estimés sur base des données communiquées par les apiculteurs belges lors de plusieurs enquêtes.
Que faire ?
L‘étude épidémiologique paneuropéenne sur les pertes de colonies51, a révélé que la Belgique est un pays avec des pertes de colonies élevées, mais avec très peu de cas cliniques de maladies comme la varroase, la nosémose, la loque ou le CBPV. L‘auteur de cet article pense que c‘est une indication de bonnes pratiques apicoles appliquées dans un environnement peu favorable, où le climat n‘aide pas.
Que faire aujourd’hui ? Côté pratiques apicoles, il faut continuer à travailler correctement, à surveiller le niveau d‘infestation de varroa et à constituer des fortes colonies. Côté environnement, même si c’est une tâche titanesque, vous n’êtes pas seul(e), communiquez vos observations à votre entourage, c‘est l’empathie qui change le monde. Côté climat, profitez des bons moments et souriez.
Références
1 Mattila, H.R., Seeley, T.D., 2007. Genetic diversity in honey bee colonies enhances productivity and fitness. Science 317, 362–364.
2 Smirle, M.J., Winston, M.L., 1987. Intercolony Variation in Pesticide Detoxification by the Honey Bee (Hymenop tera : Apidae). J Econ Entomol 80, 5–8.
3 Neumann, P., Blacquière, T., 2016. The Darwin cure for apiculture ? Natural selection and managed honeybee health. Evolutionary Applications.
4 Suchail, S., Guez, D., Belzunces, L.P., 2000. Charac teristics of imidacloprid toxicity in two Apis mellifera subspecies. Environmental Toxicology and Chemistry 19, 1901–1905.
5 Ladas, A., 1972. The influence of some internal and external factors upon the insecticide resistance of honeybee. Apidologie 3, 55–78.
6 Puerta Puerta, F., Flores Serrano, J.M., Ruiz Martinez, J.A., Ruz Luque, J.M., Campano Cabanes, F., 2001. Enfermedades de las abejas. Prevención, diagnóstico y tratamiento. Ed. COAG Andalucía y Consejeía de Agricul tura y Pesca Junta de Andalucía. ISBN : 84-607- 3323- 8.
7 Ravoet, J., Maharramov, J., Meeus, I., De Smet, L., Wenseleers, T., Smagghe, G., de Graaf, D.C., 2013. Comprehensive bee pathogen screening in Belgium reveals Crithidia mellificae as a new contributory factor to winter mortality. PloS one 8, e72443.
8 Alaux, C., Brunet, J.-L., Dussaubat, C., Mondet, F., Tchamitchan, S.,Cousin, M., Brillard, J., Baldy, A., Bel zunces, L.P., Le Conte, Y., 2010. Interactions between Nosema microspores and a neonicotinoid weaken honey bees ( Apis mellifera ). Environmental Microbiology 12, 774–782. ;
9 Doublet, V., Labarussias, M., de Miranda, J.R., Moritz, R.F.A., Paxton, R.J., 2014. Bees under stress : sublethal doses of a neonicotinoid pesticide and pathogens interact to elevate honey bee mortality across the life cycle : Pesticide-pathogen interactions in honey bees. Environmental Microbiology n/a-n/a. ;
10 Pettis, J.S., vanEngelsdorp, D., Johnson, J., Dively, G., 2012. Pesticide exposure in honey bees results in increased levels of the gut pathogen Nosema. Naturwis senschaften 99, 153–158.
11 Aufauvre, J., Biron, D.G., Vidau, C., Fontbonne, R., Roudel, M., Diogon, M., Viguès, B., Belzunces, L.P., Delbac, F., Blot, N., 2012. Parasite-insecticide inte ractions : a case study of Nosema ceranae and fipronil synergy on honeybee. Scientific reports ;
12 Vidau, C., Diogon, M., Aufauvre, J., Fontbonne, R., Viguès, B., Brunet, J.- L., Texier, C., Biron, D.G., Blot, N., El Alaoui, H., Belzunces, L.P., Delbac, F., 2011. Exposure to Sublethal Doses of Fipronil and Thiacloprid Highly Increases Mortality of Honeybees Previously Infected by Nosema ceranae. PLoS ONE 6, e21550.
13 Wu, J.Y., Smart, M.D., Anelli, C.M., Sheppard, W.S., 2012. Honey bees (< i> Apis mellifera) reared in brood combs containing high levels of pesticide resi dues exhibit increased susceptibility to< i> Nosema(Microsporidia) infection. Journal of Invertebrate Pathology 109, 326–329.
14 Bendahou, N., Bounias, M., Fleche, C., 1997. Acute toxicity of cypermethrin and fenitrothion on honey bees(Apis mellifera mellifera) according to age, formulations and (chronic paralysis virus)/insecticide interaction. Journal of Environmental Biology 18, 55–65.
15 Di Prisco, G., Cavaliere, V., Annoscia, D., Varricchio, P., Caprio, E., Nazzi, F., Gargiulo, G., Pennacchio, F., 2013. Neonicotinoid clothianidin adversely affects insect immunity and promotes replication of a viral pathogen in honey bees. Proceedings of the National Academy of Sciences 110, 18466–18471.
16 Doublet, V., Labarussias, M., de Miranda, J.R., Moritz, R.F.A., Paxton, R.J., 2014. Bees under stress : sublethal doses of a neonicotinoid pesticide and pathogens inte ract to elevate honey bee mortality across the life cycle : Pesticide-pathogen interactions in honey bees. Envi ronmental Microbiology n/a-n/a. doi:10.1111/1462- 2920.12426
17 Abbo, P.M., Kawasaki, J.K., Hamilton, M., Cook, S.C., DeGrandi-Hoffman, G., Li, W.F., Liu, J., Chen, Y.P., 2016. Effects of Imidacloprid and Varroa destructor on survival and health of European honey bees, Apis mellifera. Insect science.
18 Papach, A., Fortini, D., Grateau, S., Aupinel, P., Richard, F.-J., 2017. Larval exposure to thiamethoxam and American foulbrood : effects on mortality and cognition in the honey bee Apis mellifera. Journal of Apicultural Research 1–12.
19 López, J.H., Krainer, S., Engert, A., Schuehly, W., Riessberger-Gallé, U., Crailsheim, K., 2017. Sublethal pesticide doses negatively affect survival and the cellu lar responses in American foulbrood-infected honeybee larvae. Scientific Reports 7, 40853.
20 Nguyen, B.K., Mignon, J., Laget, D., de Graaf, D.C., Jacobs, F.J., vanEngelsdorp, D., Brostaux, Y., Saeger man, C., Haubruge, E., 2010. Honey bee colony losses in Belgium during the 2008–9 winter. Journal of Apicul tural Research 49, 337–339.
21 Sgolastra, F., Porrini, C., Maini, S., Bortolotti, L., Medrzycki, P., Mutinelli, F., Lodesani, M., 2017. Healthy honey bees and sustainable maize production : why not ? Bulletin of Insectology 70, 156–160.
22 Tsvetkov, N., Samson-Robert, O., Sood, K., Patel, H.S., Malena, D.A., Gajiwala, P.H., Maciukiewicz, P., Fournier, V., Zayed, A., 2017. Chronic exposure to neonicotinoids reduces honey bee health near corn crops. Science 356, 1395–1397.
23 Woodcock, B.A., Bullock, J.M., Shore, R.F., Heard, M.S., Pereira, M.G., Redhead, J., Ridding, L., Dean, H., Sleep, D., Henrys, P., Peyton, J., Hulmes, S., Hulmes, L., Sárospataki, M., Saure, C., Edwards, M., Genersch, E., Knäbe, S., Pywell, R.F., 2017. Country-specific effects of neonicotinoid pesticides on honey bees and wild bees. Science 356, 1393–1395.
24 Van der Zee, R., Gray, A., Pisa, L., de Rijk, T., 2015. An Observational Study of Honey Bee Colony Winter Losses and Their Association with Varroa destructor, Neonicoti noids and Other Risk Factors. PloS one 10.
25 Odoux, J.-F., Aupinel, P., Gateff, S., Requier, F., Henry, M., Bretagnolle, V., 2014. ECOBEE : a tool for long-term honey bee colony monitoring at the landscape scale in West European intensive agroecosystems. Journal of
Apicultural Research 53, 57–66.
26 Smart, M., Pettis, J., Rice, N., Browning, Z., Spivak, M., 2016a. Linking Measures of Colony and Individual Honey Bee Health to Survival among Apiaries Exposed to Varying Agricultural Land Use. PLOS ONE 11, e0152685.
27 Smart, M.D., Pettis, J.S., Euliss, N., Spivak, M.S., 2016b. Land use in the Northern Great Plains region of the US influences the survival and productivity of honey bee colonies. Agriculture, Ecosystems & Environment 230, 139–149.
28 Cariveau, D.P., Winfree, R., 2015. Causes of Variation in Wild Bee Responses to Anthropogenic Drivers. Current Opinion in Insect Science.
29 Rundlöf, M., Andersson, G.K.S., Bommarco, R., Fries, I., Hederström, V., Herbertsson, L., Jonsson, O., Klatt, B.K., Pedersen, T.R., Yourstone, J., Smith, H.G., 2015. Seed coating with a neonicotinoid insecticide negatively affects wild bees. Nature 521, 77–80.
30 Alaux, C., Brunet, J.-L., Dussaubat, C., Mondet, F., Tchamitchan, S., Cousin, M., Brillard, J., Baldy, A., Bel zunces, L.P., Le Conte, Y., 2010. Interactions between Nosema microspores and a neonicotinoid weaken honey bees (Apis mellifera). Environmental Microbiology 12, 774–782.
31 Alaux, C., Dantec, C., Parrinello, H., Le Conte, Y., 2011. Nutrigenomics in honey bees : digital gene expression analysis of pollen’s nutritive effects on healthy and varroa-parasitized bees. BMC genomics 12, 496.
32 Brodschneider, R., Crailsheim, K., 2010. Nutrition and health in honey bees. Apidologie 41, 278–294.
33 DeGrandi-Hoffman, G., Chen, Y., Huang, E., Huang, M.H., 2010. The effect of diet on protein concentration, hypopharyngeal gland development and virus load in worker honey bees (Apis mellifera L.). Journal of Insect Physiology 56, 1184–1191.
34 Scofield, H.N., Mattila, H.R., 2015. Honey bee workers that are pollen stressed as larvae become poor foragers and waggle dancers as adults. Plos one 10, e0121731.
35 Di Pasquale G, Salignon M, Le Conte Y, Belzunces LP, Decourtye A, et al., 2013. Influence of Pollen Nutrition on Honey Bee Health : Do Pollen Quality and Diversity Matter ? PLoS ONE 8 : e72016
36 Wahl, O., Ulm, K., 1983. Influence of pollen feeding and physiological condition on pesticide sensitivity of
the honey bee Apis mellifera carnica. Oecologia 59, 106–128.
37 Faucon, J.P., Flamini, C., Colin, M.E., 1985. Évaluation de l’incidence de la deltaméthrine sur les problèmes de cheptel apicole. Bulletin Vétérinaire 17, 49–65.
5 NE PAS REPETER, AJUTER SEULEMENT LE NUMERO DE REFERENCE DANS LE TEXTE
38 Medrzycki, P., Sgolastra, F., Bogo, G., Tosi, S., Venturi, S., 2011. Influence of some experimental conditions on the results of laboratory toxicological tests on honeybees, in : XI International Symposium “Hazards of Pesticides to Bees” Wageningen, The Netherlands, November. pp. 2–4.
39 Girolami, V., Marzaro, M., Vivan, L., Mazzon, L., Greatti, M., Giorio, C., Marton, D., Tapparo, A., 2012. Fatal powdering of bees in flight with particulates of neonico tinoids seed coating and humidity implication. Journal of Applied Entomology 136, 17–26.
40 Nieto, A., Roberts, S.P.M., Kemp, J., Rasmont, P., Kuhl mann, M., Gracia Criado, M., Biesmeijer, J., Bogusch, P., Dathe, H.H., De la Rúa, P., De Meulemeester, T., Dehon, M., Dewulf, A., Ortiz-Sánchez, F.J., Lhomme, P., Pauly, A., Potts, S.G., Pratz, C., Quaranta, M., Radchenko, V.G., Scheuchl, E., Smit, J., Straka, J., Terzo, M., Tomo zii, B., Window, J., Michez, D., 2014. European red list of bees. Luxembourg : Publication Office of the European Union.
41 Johnson, R.M., Pollock, H.S., Berenbaum, M.R., 2009. Synergistic interactions between in-hive miticides in Apis mellifera. Journal of economic entomology 102, 474–479.
42 Johnson, R.M., Dahlgren, L., Siegfried, B.D., Ellis, M.D., 2013. Acaricide, Fungicide and Drug Interactions in Honey Bees (Apis mellifera). PloS one 8, e54092.
43 Lequeux, R., Bruneau, E., Reybroeck, W., Jacobs, F.J., 2009. Guide de bonnes pratiques apicoles.
44 Hendrikx P., Chauzat M.P., Debin M., Neumann P., Fries I., Ritter W., et al., 2009. Bee Mortality and bee surveil lance in Europe. EFSA Journal. 1–217.
45 Vineis P., Kriebel D., 2006. Causal models in epidemio logy : past inheritance and genetic future. Environmen tal Health. 5 : 21.
46 Rothman K.J., Greenland S., 2005. Causation and Causal Inference in Epidemiology. Am J Public Health. 95 : S144–S150.
47 Goulson D., Nicholls E., Botías C., Rotheray E.L., 2015. Bee declines driven by combined stress from parasites, pesticides, and lack of flowers. Science. 347 : 1255957.
48 Becher M.A., Grimm V., Thorbek .P, Horn J., Kennedy P.J., Osborne J.L., 2014. BEEHAVE : a systems model of honeybee colony dynamics and foraging to explore mul tifactorial causes of colony failure. Journal of applied ecology. 51 : 470–482. Available : http://onlinelibrary. wiley.com/doi/10.1111/1365-2664.12222/full
49 Betti, M., 2017. Modeling Honey Bee-Plant Symbiosis in the Presence of Environmental Toxins. In 2017 AAAS Annual Meeting (February 16- 20, 2017). https:// aaas.confex.com/aaas/2017/webprogrameurekalert/ Paper19224.html.
50 Henry M., Becher M.A., Osborne J.L., Kennedy P., Aupi nel P., Bretagnolle V., et al., 2017. Predictive systems models can help elucidate bee declines driven by multi ple combined stressors. Apidologie. 48 : 328– 339.
51 Epilobee Consortium, 2016. A pan-European epidemio logical study on honeybee colony losses 2012-2014. ANSES.
