
Varroa destructor , historique d’une invasion
Endémique du continent asiatique, l’acarien parasite Varroa destructor infeste à l’origine les colonies de l’abeille asiatique Apis cerana. Chez cet hôte naturel, le Varroa est capable de se reproduire uniquement dans le couvain mâle, où les femelles entrent avant la fermeture des cellules afin d’y pondre leurs œufs. Le couvain mâle n’étant présent dans une colonie que périodiquement, la reproduction du parasite est ainsi limitée dans le temps.
Le premier contact de l’acarien Varroa destructor avec l’abeille européenne, Apis mellifera, eut lieu dans le sud-est de la Russie au milieu du vingtième siècle (Oldroyd, 1999). Le cycle de développement de l’abeille européenne étant plus long que celui de l’abeille asiatique, Varroa est alors capable de se reproduire dans tous les types de couvain, sans restriction temporelle et ainsi sans frein à l’accroissement de sa population. On estime qu’une colonie infestée s’éteint en deux à trois années en l’absence de traitement acaricide (Neumann et al., 2012).
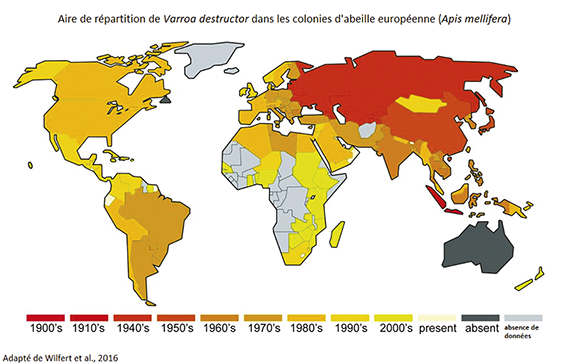
Dès le premier contact de varroa avec son nouvel hôte, le commerce de colonies a grandement aidé l’acarien dans l’irrésistible expansion de son territoire. Ainsi, Varroa destructor est à ce jour présent sur tous les continents à l’exception de l’Australie (voir figure 1).
Interactions entre hôte et parasite, principes de biologie évolutive
Le parasitisme est une interaction biologique entre deux êtres vivants dans laquelle un des protagonistes -le parasite- tire profit d’un organisme hôte pour se nourrir, s’abriter ou se reproduire. Le parasitisme joue un rôle important dans l’évolution des espèces puisqu’il exerce une constante pression de sélection : les hôtes ayant acquis des moyens de contrer leurs parasites seront ainsi favorisés, avantageant à leur tour des parasites ayant acquis des moyens de contrer les défenses de leurs hôtes. Ainsi, on voit rapidement comment les interactions hôte-parasite représentent une véritable « course à l’armement » évolutive, résultant en une situation d’équilibre dynamique entre les deux acteurs.
Dans le cas de varroa en Europe, les pertes importantes de colonies lors des années suivant son introduction ont déclenché, de façon compréhensible, un contrôle quasi systématique de l’acarien par des moyens chimiques. Bien qu’efficace les premières années, l’usage répété d’acaricides a très vite entrainé l’apparition de résistances et donc réduit l’utilité des traitements. En plus de devenir toxiques pour l’abeille à dose élevée, ces mesures de contrôle équivalent à réduire la pression de sélection et donc à empêcher l’atteinte de l’équilibre dynamique permettant la cohabitation entre l’hôte et son parasite.
Premières manifestations de résistance à Varroa
A partir des années 2000, les premiers rapports concernant des populations d‘abeilles à l’état sauvage survivant à varroa sont publiés en Suède, en France et aux Etats Unis. Bien que l’on ignore à ce moment-là les mécanismes de résistance permettant la survie de ces colonies, les faits n’en sont pas moins importants : l’acquisition d’une résistance à l’acarien est bel et bien possible chez l’abeille européenne, et ce dans un temps relativement court. Forts de cette conclusion, les chercheurs et apiculteurs néerlandais Tjeerd Blacquière, Willem Boot et Johan Calis développent leur programme de sélection, basé sur les principes fondamentaux de la sélection naturelle, que nous décrirons ci-dessous.
Variation, adaptation et hérédité
Au XIXe siècle, à la suite de nombreuses observations, les naturalistes britanniques Alfred Wallace et Charles Darwin arrivent indépendamment à une conclusion commune : les espèces vivantes évoluent par un processus qu’ils nomment « sélection naturelle ». La théorie dite « darwinienne » de l’évolution est ainsi formulée en 1859. Depuis lors enrichie par les apports de la génétique puis par la découverte de la molécule d’ADN et le développement de la biologie moléculaire, cette théorie a été et ne cesse d’être confirmée par des données empiriques.
Le principal mécanisme responsable de l’évolution, la sélection naturelle, repose sur trois principes essentiels : la variation, l’adaptation et l’hérédité. Ainsi, la variation de différents caractères au sein d’une même espèce dotera certains individus d’une meilleure capacité d’adaptation aux changements d’environnement. Les individus possédant un caractère conférant un avantage dans un milieu donné seront plus compétitifs que leurs congénères et seront alors plus à même de survivre et se reproduire. Si ce caractère avantageux est transmissible à leur descendance, alors cette descendance sera plus compétitive (toujours dans un milieu donné), survivra mieux, se reproduira plus et ainsi de suite. Par ce processus universel, toutes les formes de vies évoluent en permanence.
Dans le cas de la sélection de colonies d’abeilles, le premier principe de variation génétique est facilement applicable puisqu´au sein d’une même colonie, les ouvrières sont issues en moyenne d’une vingtaine de lignes paternelles différentes (Tarpy et al., 2015). La reine étant diploïde – c’est-à-dire qu’elle possède deux allèles de chaque gène- et les mâles haploïdes - ils possèdent un allèle seulement - on a donc, pour une ouvrière, une quarantaine de combinaisons possibles pour chaque gène. Cette diversité génétique, fréquente chez les insectes sociaux, explique l’impressionnante adaptabilité de l´abeille européenne à de très nombreux climats et flores. Ces adaptations étant en général transmises sur plusieurs générations, on les considère alors comme héréditaires, validant ainsi le troisième principe cher à la théorie de l’évolution par sélection naturelle.
Dans notre cas, il s’agit du varroa auquel les abeilles doivent s’adapter. Les mécanismes à l’origine de l’adaptation ne nous intéressent a priori pas, puisque c’est uniquement leur conséquence qui est recherchée : la survie, la bonne croissance et la reproduction de la colonie. Pour illustrer ce principe, nous nous référons à l’image de la « boîte noire » : un système dont on connait les entrées et sorties mais dont le fonctionnement interne reste invisible ou incompréhensible.
Méthode de sélection « Darwin Black Bee Box » (Boîte noire à abeilles)
La méthode de sélection « Darwin Black Bee Box » repose sur les principes de la sélection naturelle exposés plus haut : les abeilles doivent s’adapter à la contrainte parasitaire et ces adaptations doivent être transmises aux générations suivantes. Afin d’accélérer ce processus, les pressions de sélections sont accentuées : on divise les colonies pour stimuler leur croissance rapide malgré la contrainte parasitaire (on teste ainsi leur capacité à survivre) et on élimine celles qui ne parviennent pas à produire d’individus reproducteurs (reines et mâles).
Conditions nécessaires
Pour en maximiser le succès, quelques préconditions doivent être remplies avant de démarrer ce programme de sélection :
-* Un minimum de 25 à 30 colonies, idéalement d´origines différentes, est requis lors de la première saison. Ces colonies seront rapidement divisées en quatre ruchettes qui seront traitées à l’aide d’acide oxalique la première année uniquement, lorsque les jeunes reines auront démarré leur ponte. Les colonies qui survivront à l’hiver et auront une croissance suffisante ainsi qu’une production de mâles suffisante seront les colonies parentes de la prochaine année.
-* Un endroit isolé est requis pour l’accouplement des reines. On considère qu’un rayon de 3 kilomètres sans autre rucher est suffisant. En effet, plusieurs études ont conclu qu’au sein d´un rayon de 1,2 km, 60% à 75% des reines s’accouplaient avec des mâles issus de cette zone (Jaffé et al., 2009 ; Moritz et al., 2007).
-* L’arrêt de tout traitement contre varroa est nécessaire, à l’exception du traitement à l’acide oxalique de la première année. On peut cependant garder si on le souhaite un groupe contrôle, qui subira les mêmes étapes plus des traitements anti-varroa afin de pouvoir comparer les deux populations après plusieurs années.
-* L’apport de sucre aux jeunes colonies : bien que contre-intuitif, l’apport de sucre aux colonies sélectionnées a été utilisé afin d’éviter les mortalités hivernales, très souvent liées à des réserves trop faibles (Genersch et al., 2010). On sait que dans le cas de colonies sauvages, seulement, 23% des jeunes colonies survivent à leur premier hiver. Ce taux de survie monte à 84% pour une colonie dans sa deuxième année (Seeley 2017).
-* Une durée minimum de quatre ans de sélection est requise afin de pouvoir observer les premiers effets. Dans notre cas, la diminution de la reproduction du varroa a été observée de façon significative au bout de quatre ans.
Protocole au cours de la saison
Le protocole de sélection suit au mieux le cycle de développement naturel d’une colonie (figure 2) : il est important qu’un nombre suffisant de colonies soit gardé afin de pouvoir se permettre des pertes éventuelles liées aux pressions de sélection. Les colonies peuvent démarrer leur reproduction lorsqu’elles le souhaitent (production de mâles et de cellules royales), mais on évite de perdre les essaims en créant, par division, des essaims artificiels.
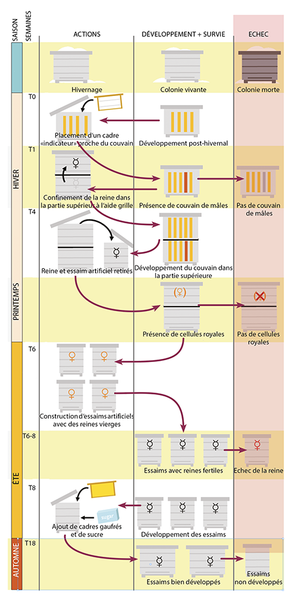
Remarque importante : les colonies écartées de la sélection (colonies ne produisant pas de reine ou de mâles, ou colonies se développant lentement) peuvent être réassimilées à un rucher « conventionnel » avant leur effondrement, ceci évidemment après avoir effectué un traitement anti-Varroa efficace.
Conclusion
Ainsi, en supprimant graduellement la lutte contre Varroa destructor et en utilisant à notre avantage la richesse de la sélection naturelle, le parasite pourrait passer du rang d’espèce invasive à celui d’espèce allochtone assimilée : une espèce d’origine externe qui, après un temps d’adaptation est assimilée à la faune locale sans avoir un impact négatif sur la biodiversité. Par exemple, le Faisan de Colchide Phasianus colchidus, introduit en Europe durant l’Antiquité (soit depuis un temps court en termes d’évolution) est aujourd’hui considéré appartenant à la faune européenne. De la même manière, la plante aquatique Elodea canadensis, l’élodée du Canada, a vu son caractère envahissant s’estomper depuis son introduction en Europe au XIXe siècle (Hérault et al., 2008).
Ce programme de sélection a prouvé son efficacité plusieurs fois dans le cadre de recherches scientifiques (Blacquière et al., 2019 ; Panziera et al., 2017 ; Kruitwagen et al., 2017 ; Oddie et al., 2017) et un contexte apicole. En effet, l’entreprise apicole néerlandaise Inbuzz v.o.f a appliqué avec succès ce programme de sélection avec la participation d’une dizaine d’apiculteurs amateurs (Van Stratum, 2016). Un autre programme similaire a été développé en France par John Kefuss, un apiculteur professionnel (Kefuss et al., 2016). C’est donc avec enthousiasme que nous invitons de nouveaux groupes d’apiculteurs à démarrer leurs propres sélections en utilisant leurs abeilles locales, déjà bien adaptées à leur climat, et à travailler ensemble de manière raisonnée à une assimilation du parasite.
Références :
- Blacquière, Tjeerd, et al. « Darwinian black box selection for resistance to settled invasive Varroa destructor parasites in honey bees. » Biological Invasions : 1-10.
- Genersch, Elke, et al. « The German bee monitoring project : a long term study to understand periodically high winter losses of honey bee colonies. » Apidologie 41.3 (2010) : 332-352.
- Hérault, Bruno, Aurélien, Bornet, and Michele, Trémolieres. « Redundancy and niche differentiation among the European invasive Elodea species. » Biological Invasions 10.7 (2008) : 1099-1107.
- Jaffe, Rodolfo, et al. « Estimating the density of honeybee colonies across their natural range to fill the gap in pollinator decline censuses. » Conservation biology 24.2 (2010) : 583-593.
- Kefuss, John, et al. « Selection for resistance to Varroa destructor under commercial beekeeping conditions. » Journal of Apicultural Research 54.5 (2015) : 563-576.
- Kruitwagen, Astrid, et al. « Naturally selected honey bee (Apis mellifera) colonies resistant to Varroa destructor do not groom more intensively. » Journal of Apicultural Research 56.4 (2017) : 354-365.
- Moritz, Robin FA, et al. « The size of wild honeybee populations (Apis mellifera) and its implications for the conservation of honeybees. » Journal of Insect Conservation11.4 (2007) : 391-397.
- Neumann, Peter, Robin FA Moritz, and Job van Praagh. « Queen mating frequency in different types of honey bee mating apiaries. » Journal of Apicultural Research 38.1-2 (1999) : 11-18.
- Neumann, Peter, et al. « Varroa invasion and virus adaptation. » Trends in parasitology 28.9 (2012) : 353-354.
- Oddie, Melissa AY, Dahle, Bjørn, and Neumann, Peter. « Norwegian honey bees surviving Varroa destructor mite infestations by means of natural selection. » PeerJ 5 (2017) : e3956.
- Oldroyd, Benjamin P. « Coevolution while you wait : Varroa jacobsoni, a new parasite of western honeybees. » Trends in Ecology & Evolution 14.8 (1999) : 312-315.
- Panziera, Delphine, van Langevelde, Frank, and Blacquière, Tjeerd,. « Varroa sensitive hygiene contributes to naturally selected varroa resistance in honey bees. » Journal of Apicultural Research 56.5 (2017) : 635-642.
- Seeley, Thomas D. « Life-history traits of wild honey bee colonies living in forests around Ithaca, NY, USA. » Apidologie 48.6 (2017) : 743-754.
- Tarpy, David R., Delaney, Deborah A., and Seeley, Thomas D. « Mating frequencies of honey bee queens (Apis mellifera L.) in a population of feral colonies in the northeastern United States. » PLoS One 10.3 (2015) : e0118734.
- Van Stratum Pam. “Vitale bijen hebben de toekomst. » Bijen- houden 10(5) (2016):14–15
