A l’intérieur du nid, les conditions d’élevage des formes immatures sont assurées et régulées principalement par les ouvrières nourrices et les chauffeuses (voir les synthèses de Winston, 1987 et de Tautz, 2008). Cette régulation de l’homéostasie du nid se traduirait par des durées constantes pour les trois grands stades de développement de l’abeille (œuf, couvain ouvert et couvain fermé).
Selon la plupart des auteurs de la lit térature scientifique antérieure à 1934, la durée totale du cycle de dévelop pement de l’ouvrière est de 21 jours (Jay, 1963). Plus tard, Rembold et al. (1980) observent une durée totale de 20,5 jours sur A. m. carnica, en partie dans des conditions de laboratoire. Dans des conditions naturelles Fukuda et Sakagami (1968) rapportent une durée moyenne de 20 jours pour la sous-es pèce A. m. ligustica importée au Japon. Pour l’abeille africaine (A. m. adanso nii) la durée totale de développement est plus courte : entre 19 et 20 jours selon Smith (1958) ou 18, 6 jours selon Fletcher (1978). L’abeille africanisée, issue d’une hybridation entre ces deux sous-espèces, présente une durée com prise entre 19,8 et 20,3 jours (Nunes-Silva et al., 2006). Ces données de la littérature montrent qu’il existe des variations entre les sous-espèces mellifera et les attribuent à une origine génétique (Jones et al., 2004 ;) et/ou à la thermorégulation du couvain (Southwick and Heldmaier, 1987 ; Becher and Moritz, 2009). Cependant à ce jour la littérature scientifique est imprécise sur l’étendue des variations de durée à l’intérieur d’une sous-espèce, d’une lignée ou des colonies d’un rucher.
Du point de vue ontogénétique, le contrôle de la température est déterminant pour la vitesse de développement des formes immatures et particulière ment pour la construction de leur système nerveux central (Groh et al. 2004) et par voie de conséquence pour le comportement du futur insecte adulte (Tautz et al., 2003).
Dans les relations hôte-parasite, la durée de l’operculation influence le succès reproducteur de certains acariens comme Varroa spp ou Tropilaelaps spp, qui eux-mêmes perturbent le dévelop
pement normal des formes immatures d’abeille subissant leur parasitisme (voir la synthèse de Rosenkranz et al., 2010).
Des troubles de développement, en particulier un allongement ou un rac courcissement des durées de certains stades larvaires sont observés après expositions des formes immatures à des Régulateurs de Croissance pour Insectes (voir les synthèses de Tasei, 2001 et de Dhadialla et al., 2005).
Le réchauffement climatique a aussi des conséquences directes sur le développe ment des insectes selon Kingsolver et al. (2018). Toutefois ces auteurs n’évoquent pas les insectes sociaux. La question est donc de savoir si une adaptation au réchauffement climatique entraîne une modification de la régulation thermique des colonies d’abeilles et donc de la durée des cycles de développement.
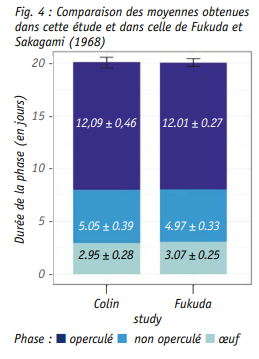
Le premier but de l’étude présentée est de quantifier et d’analyser les variations entre colonies d’un même rucher de production avec un nombre d’observations individuelles suffisant pour permettre des comparaisons avec la puissance statistique requise. Le deuxième but est de savoir si les durées de développement relevées en 2018 sont comparables à celles citées dans la littérature et particulièrement celles de Fukuda et Sakagami (1968) utilisant un protocole proche du nôtre.
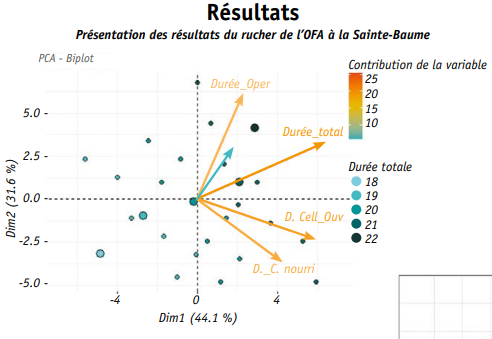
D’après l’analyse en composantes principales des résultats le nuage de points dans le premier graphe semble assez restreint bien qu’un total de 2220 individus ait été suivi. Plus précisément, l’ensemble de ces 2220 valeurs se résume en 24 combinaisons différentes de durées du stade œuf, larvaire et nymphal représentées sur le graphe par les 24 points.
La variabilité est en réalité contrainte par le fait que les durées aient été mesurées en jours. Certaines combinaisons de durées sont rares (stade œuf de durée 1 jour, stade nourri 7 jours et operculation 11 jours), d’autres très fréquentes (3 jours pour l’œuf, 5 jours pour le stade nourri et 12 jours d’operculation, dans
plus de la moitié des cas).
Hormis la durée du stade œuf, toutes les autres variables sont bien représentées dans le nouveau repère d’axes. Certaines durées sont liées entre elles comme la durée de l’ouverture des cellules et celle du stade nourri. La durée totale est, quant à elle, corrélée à toutes les autres, d’où sa position centrale dans le graphe. Enfin, la projection de la variable colonies dans le nouveau référentiel d’axes confirme que la variabilité est restreinte bien que deux colonies (c255 et c174) semblent s’écarter des autres.
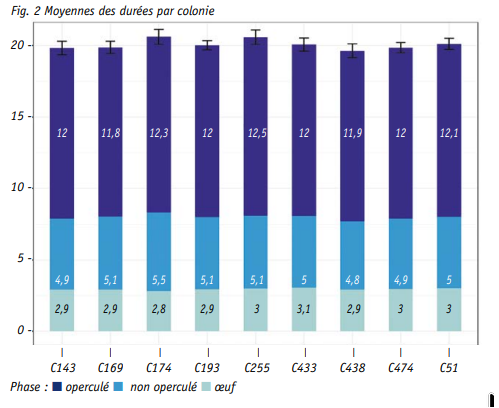
Les moyennes des différentes colo nies présentent peu de variabilité. La durée totale moyenne de 20.09 ± 0.56 jours. Elle est subdivisée en 2.95 ± 0.28 jours pour le stade œuf, 5.05 ± 0.39 jours pour le stade nourri et 12.09 ± 0.46 jours de durée d’oper culation.
La durée du stade œuf reste peu dis criminante puisque 92.2 % des abeilles restent à l’état d’œuf pendant 3 jours, la seconde durée la plus fréquente étant 2 jours avec 6.5 % des individus. Les durées du stade larvaire nourri et du stade operculé sont quant à elles légèrement plus variables. Elles fluctuent entre 4, 5 ou 6 jours dans respectivement 4.8, 84.7 et 10.3 % des cas pour le stade nourri et entre 11, 12 ou 13 jours
dans 6.4, 78.5 et 14.9 % des cas pour le stade operculé. C’est au final sur la durée totale que la plus grande fluctuation est observée, ce qui semble assez logique puisque toutes les variabilités intermédiaires sont alors prises en compte.
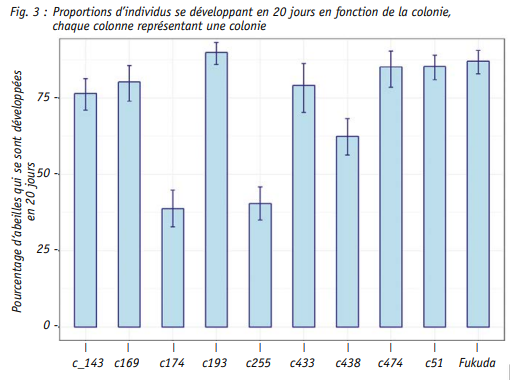
Soixante-neuf pour cent des individus se développent ainsi en 20 jours contre 10.9 % en 19 jours et 19.9 % en 21 jours.
Il semble donc cohérent que la durée totale moyenne du développement de l’abeille ouvrière ait été mesurée à 20.09 jours. Bien que la variabilité soit très faible avec une erreur standard calculée à 0.01, les différences au sein et entre les colonies ont été étudiées. Ainsi, la proportion d’individus répartis dans chacune des 3 durées (19, 20 et 21 jours) dépend significativement de la colonie d’origine (test chi carré). La propor tion d’individus s’étant développée en 20 jours est par exemple plus faible dans les colonies c174 et c255, ce qui confirme les résultats de l’ACP (stat GLM, Fig. 4). La colonie c438 diffère également des 6 autres colonies pour lesquelles plus de 75 % des individus se sont développés en 20 jours.
Durées totales et comparaison avec Fukuda et Sakagami (1968)
Les résultats de l’étude de Fukuda et Sakagami (1968) ont été comparés à ceux obtenus dans notre étude. Les moyennes et écart-types mesurées dans ces deux études sont extrême ment proches Néanmoins, la proportion d’individus répartis dans chacune des 3 durées (19, 20 et 21 jours) diffère significativement entre nos deux études (stat chi carré, Fig. 4). Plus précisé ment, un pourcentage plus important d’individus s’écartant de la moyenne a été détecté dans notre étude (Fig. 3).
Discussion
Limites de la comparaison avec Fukuda et Sakagami (1968) : cette comparai son est proposée à titre informatif car les données des auteurs japonais n’ont pas suivi un plan d’échantillonnage rigoureux. De plus il est difficile d’attribuer des différences ou des ressemblances à un facteur plus qu’à un autre car l’étude s’est déroulée au Japon, sur des abeilles d’importation, il y a 50 ans.
Comparaison avec la littérature ancienne : les résultats des différentes durées de développement observées dans notre étude pourraient sembler proche de celle relevées sur l’abeille africaine mais il serait incorrect de valider cette conclusion sans l’apport d’autres études utilisant notre protocole et statistiquement robustes.
Premiers éléments pour une base de données fiable : la littérature scientifique s’est révélée pauvre en données exploitables pour des comparaisons car les articles présentent une grande disparité dans les protocoles et dans les analyses statistiques lorsqu’elles sont présentes. Les études antérieures sont surtout centrées sur la détermination de moyennes alors que la répartition des données et les variations autour de la moyenne ou de la médiane donnent aussi des informations importantes pour une interprétation biologique des résultats beaucoup plus fine. Il y a donc lieu d’établir un consensus scientifique pour proposer un protocole universel répondant à ces nécessités.
Cycle de développement et Varroa destructor : les variations de durées des stades de développement entre sous-espèces, races et lignées, si elles étaient confirmées, pourraient être retenues comme un des critères de choix pour une abeille plus tolérante au parasite.
Conclusion
Cette étude apporte des données fondamentales sur le cycle de l’abeille en 2018. Elle est le premier élément d’une base de données qu’il faudrait construire de par le monde et dont l’objet serait de suivre l’évolution du cycle de développement en fonction des races d’abeilles et des climats. Les données du cycle seraient ainsi confrontées à celles relevées dans les manuels d’apiculture et dans les méthodes de référence comme pour celle traitant de l’élevage des larves en étuve (OCDE, essai 237).
La variabilité entre les individus d’une même colonie, sur ces critères de durée, a été mise en évidence dans notre étude. Elle peut s’expliquer par plusieurs raisons : (i) une différence de soins aux immatures, (ii) un potentiel génétique différent, (iii) l’action sub-létale de pesticides ou d’agents pathogènes. Quant aux variations observées entre colonies de notre rucher, elles sont vraisemblablement d’origine génétique plutôt que d’origine climatique. Cette constatation conforte l’idée d’une lutte biologique contre Varroa destructor par sélection génétique d’abeilles fondée en partie sur des particularités de leurs cycles de développement.
L’étude de la composante climatique, si importante en cette période de réchauffement pourrait se réaliser dans le cadre d’un réseau international d’observation des colonies d’abeilles et en particulier de valeurs quantifiées relevées dans leur cycle de développement.
MATÉRIEL ET MÉTHODE
Rucher et colonies d’abeilles
Le rucher expérimental de l’Observatoire Français d’Apidologie est situé au Nord-Est de Marseille dans le massif de la Sainte Baume, vaste zone de forêts à Quercus spp. Isolée de toute culture intensive. Les colonies y ont été amenées au printemps 2018 et laissées pendant tout le reste de l’année. Les abeilles sont des hybrides destinés à la production de miel. Neuf colonies sur les trente du rucher ont fait l’objet de l’étude.
Protocole
Une surface d’alvéoles d’ouvrières est photographiée quotidiennement depuis la ponte de l’œuf jusqu’à l’émergence de l’abeille adulte. Comme dans l’expérience de Fukuda et Sakagami (1968), la zone observée est délimitée par un gabarit lozangique placé toujours au même endroit de la surface du cadre. Ainsi chaque alvéole est repérée par ses coordonnées sur deux côtés du gabarit.
Pour obtenir un nombre d’alvéoles suffisant pour assurer la robustesse des tests statistiques, la surface du gabarit est de 400 alvéoles au lieu de 100 pour Fukuda et Sakagami (1968). Chaque côté du gabarit mesure 12 cm avec des angles de x° et y°. A heure précise, le cadre contenant la zone observée est sorti de la ruche, puis le gabarit est placé en position définie par rapport à des repères sur le bois du cadre. La photographie
est prise avec un appareil photo numérique muni d’un objectif de focale 70 mm qui permet de distinguer clairement le fond de chaque alvéole et son contenu à condition de prendre 4 photos d’environ 100 alvéoles pour couvrir la surface du losange.
Analyse des photos
Chaque alvéole est représentée par une cellule identifiée par sa position sur une ligne et sur une colonne d’un tableur Excel. Le contenu de la cellule (œuf, larve, alvéole operculée, vide) est indiqué par un symbole et une couleur. Les 400 cellules du gabarit sont ainsi représentées chaque jour dans une feuille du tableur pendant toute la durée d’observation. Ainsi, à partir du jour de l’émergence d’une l’abeille adulte, il est
facile de retrouver le jour de l’operculation, le jour de l’éclosion de l’œuf et le jour de sa ponte puis d’en déduire les durées suivantes : stade œuf, nourrissage de la larve, couvain ouvert, couvain operculé, totalité du développement.
Statistiques
L’analyse statistique a été realisée au moyen du logiciel R 3.4.3. les graphes ont été créés par la section ggplot2 du logiciel R. Les durées de développement ont d’abord été soumises à des statistiques descriptives. L’analyse en composantes principals (ACP) montre le degré de variabilité.
Les colonies ont été ensuite repérées sur de nouveaux axes pour visualiser ces différences. Les durées moyennes et les déviations-standard ont ensuite été calculées pour plus de précision sur la variabilité.
Comme la distribution des valeurs de durée n’est ni normale ni homosédastique, des tables particulières ont été utilisées. Puisque 99 % des durées des différentes phases est décrite par trois valeurs, on considère ces valeurs comme des catégories, donc les individus classés dans ces catégories sont comptés dans chaque colonie. Les tableaux sont ensuite analysés par un test de chicarré. Les mêmes tableaux sont aussi utilisés
pour la comparaison entre nos résultats et ceux de Fukuda et Sakagami (1968).
La proportion d’individus possédant une durée de développement de 20 jours a ensuite été analysée par un modèle linéaire généralisé avec l’origine de la colonie ou les deux études comme facteurs explicatifs
Colin Marc-Edouard*, Piou Vincent**, Pillot Céline*, Mougenot Dimitri*, Tabart Jérémy*
* Observatoire Français d’Apidologie, Route de la Sainte Baume, F-83136 Mazauguess
** UNI Champollion, laboratoire Evolution et Diversité Biologique, Place de Verdun, F-81000 Albi
Références
Becher M. and Moritz R. 2009 A new device for continuous temperature measurement in brood cells of honeybees (Apis mellifera) Apidologie, 40 (5), <10.1051/apido/2009031>
. <hal-00892021>
Dhadialla T., Retnakaran A., Smagghe G. 2005 Insect Growth- and Development-Disrupting insec ticides In :Comprehensive insect molecular science, Pergamon, Elsevier BV, 6, 55-115.
Fletcher D. 1978 The African bee, Apis mellifera adansonii, in Africa Ann. Rev. Entomol. 23, 151- 171.
and workers during ontogenetic development. Braz. J. Morphol. Sci. 23, 325-332.
Rembold H., Kremer J.P., Ulrich G. 1980 Charac terization of the post embryonic developmental stages of the female castes of the honey bee Apis mellifera L. Apidologie 11, 24_38.
Rosenkranz P., Aumeier P., Ziegelmann B. 2010 Biology and control of Varroa destructor J. Invertebr. Pathol. 103,96–119.
Smith F. 1958 Beekeeping observations in Tan ganyka 1949 Bee World 39, 29-36.
Southwick E. and Heldmaier G. 1987 Temperature control in honey bee colonies. BioScience, 37, 6, 395-399.
Tasei J.N. 2001 Effects of insect growth regula tors on honey bees and non- Apis bees. A review. Apidologie 32 (2001) 527–545.
Tautz J. 2008 The buzz about bees. Biology of a superorganism. Springer, Berlin. 284 pp., ISBN : 9783-540-78727-3.
Tautz J., Maier S., Groh C., Roessler W., Brockmann A. 2003 Behavioral performance in adult honey bees is influenced by the temperature experienced during their pupal development PNAS, 100, 12, 7343–7347
Winston M. 1987 The biology of the honey bee. Harvard University Press, Cambridge.
