Lʹobjectif de notre travail est de déterminer la Concentration Minimale Inhibitrice (CMI) de plusieurs lots de propolis dʹorigines botaniques différentes en fonction de leurs teneurs en principes actifs et de comparer leur activité antibactérienne sur un large panel de bactéries gram+ et gram-.
La propolis est une substance résineuse récoltée par les abeilles sur les bourgeons, les arbres ou les arbustes dans l’écosystème végétal proche de la ruche. Bien qu’il existe une multitude de variété de propolis, trois ont fait l’objet d’études approfondies tant d’un point de vue de leur identification, que de leur caractérisation et de leurs activités bio logiques (Cardinault et al. 2012, Salatino et al. 2011). La propolis est bien documentée pour exercer des activités antibactériennes, antifongiques, antivirales, antioxydantes, anti-inflammatoires, immuno-modulatrices ou anti-tumo rales (Pasupuleti et al. 2017 ; Al-Ani et al. 2018). Les principaux constituants actifs responsables de ces activités incluent des acides phénoliques et leurs dérivés ainsi que différentes classes de flavonoïdes.
La seule certitude qui semble exister aujourd’hui s’accorde sur le fait que les propolis (de diverses origines botaniques) semblent plus efficaces contre les bactéries gram+ que sur les gram-. En effet, comme les principes actifs supposés responsables de cette activité n’ont pas été dosés, les résultats de ces différentes études ne peuvent pas être objectivement comparés. L’interprétation sur l’efficacité d’une propolis par rapport à une autre peut même être complètement inversée selon que l’on a standardisé ou non les extraits utilisés sur les teneurs en principes actifs, afin de comparer les résultats à teneur équivalente en principes actifs (Letullier et al 2019).
Résultats : Polyphénols totaux et concentration minimale inhibitrice
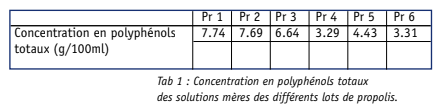
On a déterminé la teneur en polyphénols totaux de nos différentes solutions mères issues de différentes propolis brune de peuplier (Pr 1, 2, 3), verte de Baccharis (PR 4, 5) et rouge de Dalbergia (Pr 6) (tableau 1), selon une technique décrite en matériel et méthode. On constate que les solutions de propolis de peuplier sont en moyenne deux fois plus concentrées en polyphénols totaux que les propolis de Baccharis ou de Dalbergia.
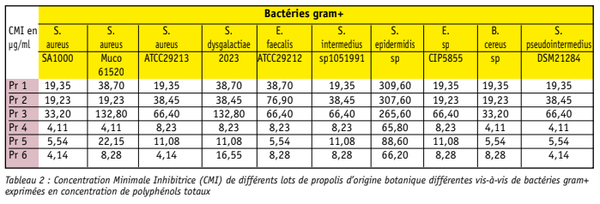
Dans ce travail nous avons également comparé l’activité antibactérienne de ces types botaniques de propolis extraits selon le même protocole, sur des souches gram+, gram- et champignon. Mais à la différence de la plupart des autres études, nous n’avons pas exprimé la CMI en volume de la solution testée, mais en fonction de la concentration en principes actifs contenus dans chacune des solutions. Les résultats des CMI pour les bactéries gram+, gram– et champi gnon sont présentés dans les tableaux 2 et 3, respectivement. La souche gram+ la moins sensible quelque soit l’extrait de propolis est Staphylococcus epidermidis sp. Toutes les autres souches testées ont une CMI comprise entre 4.11 et 309.6 µg/ml. Le lot Pr 3 présente une CMI presque toujours plus élevée que les autres lots de propolis sur les souches testées. Enfin, les lots de propolis verte et rouge ont des CMI de 2 à 4 fois plus efficaces que la propolis de peuplier pour toutes les souches de bactéries gram+.
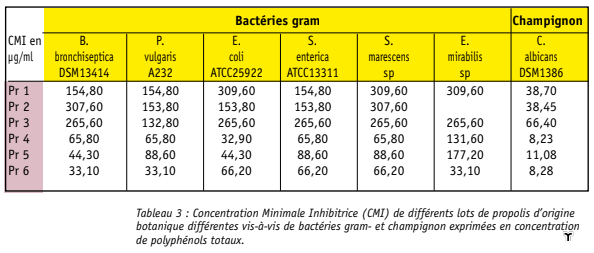
Nos résultats montrent que nos différents lots de propolis n’ont aucune activité antibactérienne vis-à-vis des 9 bactéries gram- suivantes (Pseudo monas aeruginosa, de Klebsiella pneumoniae, de Acinobacter Baumannii et deEnterobacter aerogenes). Pour toutes les autres souches gram- (Bordetella bronchiseptica, Proteus vulgaris, Proteus mirabilis, Salmonella enterica, Serratia marescens, Escherichia coli), les CMI de nos différents lots sont comprises entre 33.1 et 309.6 µg/ml et sont plus élevées que celles obtenues sur les gram+. Il semble que les propolis rouge et verte soient plus efficaces sur ces bactéries d’un facteur 2 à 7 par rapport à la pro polis de peuplier. Enfin, tous les lots de propolis sont efficaces vis-à-vis de Candida albicans avec des CMI comprises entre 8.28 et 66.4 µg/ml, soit proches des valeurs obtenues pour les gram+. Là encore, les propolis vertes et rouge sont 3 à 6 fois plus efficaces que les propolis de peuplier sur ce champignon.
Résultats : extraits éthanoliques et dérivés hydrosolubles
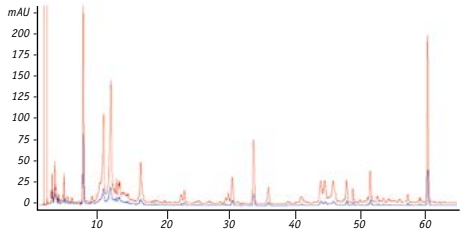
L’alcool étant un frein dans l’interprétation de nos résultats mais également dans l’utilisation du produit final, nous décidons de réaliser une seconde série d’expérience indépendante où nous réa lisons une version hydrosoluble à partir de nos extraits éthanoliques de propolis. Avec la technique utilisée pour obtenir les résultats repris ci-dessus, la limite maximale au delà de laquelle il n’est plus possible d’établir une CMI interprétable est de 4µl, car la quantité d’alcool pré sente dans le puits devient cytotoxique. Dans cette deuxième partie de l’expérience, nous nous focaliserons unique ment sur les propolis les plus actives (Baccharis et Dalbergia), où nous testerons comparativement l’activité antibactérienne de la version éthanolique initiale avec sa version hydrosoluble. Sur les figures 1A, et 1B sont présentés les chromatogrammes de nos extraits éthanoliques et leur dérivé hydrosoluble. Nous pouvons constater pour les deux types de propolis que l’ensemble des composés présents dans l’extrait éthanolique initial est bien présent dans son homologue hydrosoluble mais en moins grande quantité. Notre technique de solubilisation nous a permis de conserver l’ensemble du profil polyphénolique des deux types de propolis, avec seule ment une perte globale comprise entre 15 et 22 % des polyphénols totaux.
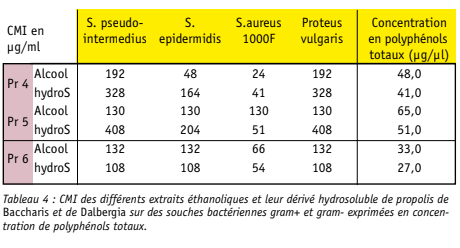
Les résultats de l’activité antibactérienne de nos différents extraits éthanoliques et leur version hydrosoluble vis-à-vis de quelques bactéries gram+ sont présentés dans le tableau 4. On peut s’apercevoir que pour la propo lis verte de Baccharis (Pr4 et Pr 5) les versions éthanoliques ont une meilleure efficacité que leur version hydrosoluble (à l’exception de Pr 5 pour S. aureus). On note toutefois que c’est l’inverse pour la propolis de Dalbergia où le dérivé hydro soluble semble plus efficace que son précurseur éthanolique.
Discussion : une activité liée à quelques composés : une relation bactérie / composés / dose à déterminer.
Ces différents types botaniques de pro polis présentent des profils polyphé noliques très différents. La propolis de peuplier est plutôt riche en flavonoïdes et acides phénols et leurs dérivés esters, la propolis de Baccharis est riche en acides prénylés et la propolis de Dalbergia est riche en isoflavonoïdes. Ces molécules ont des propriétés d’ab sorption spectrales très différentes qui expliquent pourquoi nous avons analysés nos extraits selon les standards les plus représentatifs de chacun des types de propolis et qui ont fait l’objet d’études de validation (Popova et al 2004, Ban
kova et al.2016).
Nous constatons que nos trois types botaniques de propolis présentent une concentration différente en principes actifs alors qu’ils ont subit exacte ment le même procédé d’extraction. La propolis de peuplier a une teneur en polyphénols totaux naturellement plus importante que les propolis de Baccharis et de Dalbergia. Nos résultats montrent une plus grande efficacité antibactérienne de nos différentes propolis sur des bactéries gram+ et champignon que sur des gram-, en accord avec la littérature (Boufadi et al., 2014 ; Sanpa et al, 2017). Cette étude comparative entre différents types de propolis montre que les propolis verte de Baccharis et rouge de Dalbergia sont plus actives que la propolis de peuplier quel que soit le type de bactéries testées. Ces résultats sont en accord avec d’autres études compa ratives (Letullier et al 2019 ; Deegan et al 2019). Nos résultats révèlent que les lots de propolis de Baccharis et Dalbergia moins concentrés en principes actifs que ceux de peupliers sont pourtant les plus actifs. Il semble donc que la concentration totale en polyphénols totaux ne soit pas le seul élément qui détermine l’efficacité d’une propolis. On notera cette hétérogénéité dans les résultats des différents lots de propolis de peuplier. Le lot Pr 3 a en moyenne une CMI de 2 à 7 fois plus élevée que celle des autres lots de propolis de peuplier sur les bactéries gram+ (à l’exception de S. epidermidis) alors que sa teneur en principes actifs est seulement 17 % plus faible que celle des autres.
A contrario, cette différence ne semble pas affecter les résultats sur les bactéries gram-. Notre seconde expérience s’est concentrée sur le fait d’éliminer l’éthanol qui est un frein dans nos expérimentations mais également dans l’utilisation au quotidien de ce type de produit par les consommateurs. Pour cela, nous avons réussi à partir de nos extraits éthanoliques à solubiliser l’ensemble des principes actifs initialement présents. Ce résultat est très différent d’une extraction aqueuse qui ne permet pas de conserver l’ensemble du profil des actifs de la propolis (Sun et al. 2015). Alors que la baisse de teneur en polyphénols totaux (de 15 à 22 %) dans nos extraits hydrosolubles de propolis de Baccharis est associée à une réduction de l’efficacité antibactérienne d’un facteur 2 en moyenne pour l’ensemble des germes testés, la baisse similaire en polyphénols totaux observée dans notre extrait hydrosoluble de propolis de Dalbergia semble avoir au contraire amélioré l’efficacité de l’extrait.
L’ensemble de ces résultats semble renforcer l’idée que plus que la concentration totale en polyphénols, la présence de seuls quelques composés particuliers et spécifiques à l’espèce botanique de la propolis est responsable de son activité antibactérienne. Cette idée a déjà été rapportée par Bueno-Silva et al. (2013) qui ont montré que l’activité anti-in flammatoire d’un extrait de propolis était principalement due à seulement 2 ou 3 molécules de ce mélange. Trusheva et al (2006) avait montré après plusieurs séries de purification d’un extrait éthanolique de propolis que deux molécules étaient principalement responsables de l’activité antifongique alors que deux autres molécules étaient plutôt responsables d’une activité antibactérienne. Nos résultats sont en accord avec cette hypothèse qui démontrent que seuls quelques composés, parmi l’ensemble des polyphénols présents dans la fraction, sont responsables de l’activité bio logique, et réciproquement, que chaque activité biologique est sous la dépendance d’un ensemble restreint de composés mais pas de tous les composés.
Ces résultats très prometteurs mériteront d’être renforcer pour améliorer notre compréhension sur quel type de propolis est la plus efficace pour lutter contre quel germe, avec quelles molécules actives et à quelle dose de ces molécules spécifiques. Le développement de forme hydrosoluble efficace, plus facile d’accès au plus grand nombre, permettrait de présenter les extraits de propolis comme une alternative crédible aux antibiotiques en première intention.
MATÉRIELS ET MÉTHODES
1) Préparation des extraits de Propolis
Dans cette étude nous avons utilisé 3 lots de propolis de peuplier fournis par des apiculteurs français (Pr 1, 2, 3), et 2 lots de propolis verte de Bacharris dracunculifolia (Pr 4, 5) et un lot de propolis rouge de Dalbergia escastophyllum (Pr 6) fournis par des producteurs brésiliens. Tous les lots ont fait l’objet d’une analyse chromatographique (Bankova et al. 2016) pour confirmer l’identité botanique de la plante source de ces différentes propolis. Les propolis ont été réduites en poudre et ajoutées avec de l’alcool à 70° pour macération sous agitation magnétique pendant 48h. Les macéras ont été doublement filtrés sur du papier whatman N°4. Les filtrats constituent les solutions mères de chacun de nos lots de propolis. Les analyses de ces solutions ont montré l’absence d’antibiotique, de pesticide et des valeurs de métaux lourds dans les normes réglementaires.
2) Détermination des polyphénols totaux
Les polyphénols totaux sont analysés selon les méthodes de références décrites par Bankova et al. (2016). Brièvement, après dilution de la solution dans un volume adéquat de méthanol, 0.5 ml sont ajoutés à 7.5 ml d‘eau distillée, 2 ml de réactif de Folin-Ciocalteu et 3ml d‘une solution aqueuse de carbonate de sodium à 20 %. Le tout est complété à 25 ml avec de l‘eau distillée, puis laissé à température ambiante pendant 2 heures à l’abri de la lumière. Les absorbances sont mesurées au spectrophotomètre à 760 nm. La courbe de calibration est obtenue à partir d’une solution pinocembrine/galangine (2/1) pour les propolis de peuplier et d’une solution d’acide gallique pour les propolis de Baccharis et de Dalbergia. Les résultats sont exprimés en mg de polyphénols totaux/ml de solution mère.
3) Activité antibactérienne de la propolis
L’activité antibactérienne est déterminée sur 10 souches de bactéries gram+, 15 souches de bactéries gram- et 1 champignon. La concentration mini male inhibitrice (CMI) des composés a été déterminée dans une microplaque 96 puits stérile en utilisant la méthode de microdilution standardisée confor mément aux recommandations de la Société Française de Microbiologie (Comité de l‘Antibiogramme de la Société Française de Microbiologie, CA-SFM). Les souches bactériennes sont cultivées sur gélose trypticase soja (TSA, Becton Dickinson) à 37°C pendant 24h. Les inoculums sont préparés dans du TCE (tryptone 0,1 %, NaCl 8 %, poids/volume) en ajustant la turbidité à 623 nm pour obtenir 1-3.105 UFC/mL. Dix µl de solution mère de propolis sont ajou tés à 90 µl de milieu et transférés dans les premiers puits de la microplaque contenant 100 µL de l’inoculum comportant 2-6.105 UFC de bactérie. Une série de dilution de 2 en 2 est ensuite réalisée afin d’obtenir un gradient de volume en extrait alcoolique P1-P6 variant de 4 à 0.0039 µL. Certains puits sont réservés comme contrôles positifs pour attester de la viabilité de l‘inoculum bactérien (milieu de culture ensemencé) ou comme contrôle négatif (milieu culture stérile). Des contrôles d’efficacité antibactérienne sont réalisés à partir d’antibiotiques. Après 24h d‘incubation à 37°C, la CMI est définie pour chaque molécule comme étant la plus faible concentration en composé ne permettant plus aucune croissance bactérienne visible. La lecture de la CMI a été réalisée si nécessaire par l’ajout d’iodure de nitrotétrazolium. Les mesures de CMI de chaque extrait ont été réalisées au minimum en dupliquât.
Remerciements à Florence Bonsch, aux équipes de l’OFA, à Jean-Michel Brunel, Directeur de Recherche à U1261 INSERM (Faculté de Pharmacie de l’Université Aix-Marseille), et au fonds Seviajer.
Références :
Al-Ani et al. (2018). Antimicrobial Activities of European Propolis Collected from Various Geographic Origins Alone and in Combination with Antibiotics. Medicines (Basel). Jan 3 ;5(1).
Bankova et al. (2016). Standard methods for Apis mellifera propolis research. Journal of Apicultural Research, 58(2), 1–49.
Boufadi et al. (2014). Characterization and antioxidant properties of six Algerian propolis extracts : ethyl acetate extracts inhibit myeloperoxi dase activity. Int J Mol Sci. Feb 7 ;15(2):2327-45.
Bueno-Silva et al. (2013). Antiinflammatory and antimicrobial evaluation of neovestitol and vestitol isolated from Brazilian red propolis. Journal of Agricultural and Food Chemistry, 61(19), 4546–4550.
Cardinault et al. (2012). La propolis : Origine, composition et propriétés. Phytotherapie, 10(5), 298–304.
Deegan et al. (2019) Susceptibility of Malasse zia pachydermatis Clinical Isolates to Allopathic Antifungals and Brazilian Red, Green, and Brown Propolis Extracts. Front Vet Sci. Dec 13 ;6:460.
Letullier et al. (2020). Comparison of the antibac terial efficiency of propolis samples from different botanical and geographic origins with and without standardization. Journal of Apicultural Research, 59(1), 19-24.
Pasupuleti et al. (2017). Honey, Propolis, and Royal Jelly : A Comprehensive Review of Their Bio logical Actions and Health Benefits. Oxid Med Cell Longev. Jul 26. Review.
Popova et al. (2004). Validated methods for the quantification of biologically active constituents of poplar-type propolis. Phytochemical Analysis, 15(4), 235–240.
Salatino et al. (2011). Propolis research and the chemistry of plant products. Nat. Prod. Rep., 28, 925.
Sanpa et al. (2017). Chemical profiles and antimicrobial activities of Thai propolis collected from Apis mellifera. Chiang Mai Journal of Science, 44(2), 438–448.
Sforcin et al. (2000). Seasonal effect on Brazilian propolis antibacterial activity. Journal of Ethno pharmacology, 73(1-2), 243–249.
Sun et al. (2015). Effect of Ethanol/Water Solvents on Phenolic Profiles and Antioxidant Properties of Beijing Propolis Extracts. Evid Based Complement Alternat Med. Aug 17.
Trusheva, et al. (2006). Bioactive constituents of Brazilian red propolis, Evidence-Based Complement. Altern. Med. 3.
