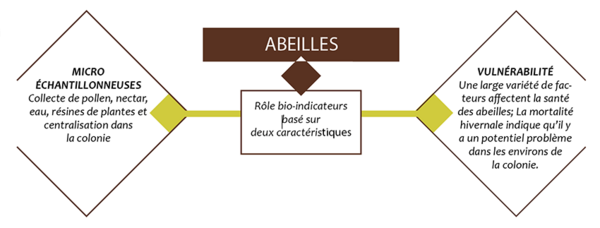
Quelques espèces d’organismes vivants comme les lichens, les mousses, les escargots, ou les abeilles peuvent être considérées comme des bio-indicateurs, c’est-à-dire des êtres vivants présents et distribués largement sur la surface du globe et capables de contribuer à l’évaluation de la qualité de l’environnement, ce dernier étant soumis à l’influence de l’anthropisation (Holt and miller, 2011). Le rôle de bio-indicateur des abeilles est fondé sur deux caractéristiques (Figure 1) : d’une part les abeilles sont de micro-échantillonneuses de leur environnement. Elles récoltent pollen, nectar/miellat, eau et résine des arbres et les ramènent à leur ruche ou aux endroits de nidification. D’autre part, du fait du contact étroit qui les lie avec la nature et de leur biologie, elles sont vulnérables à ce qui se passe autour d’elles. Nous allons d’abord explorer ce que nous pouvons conclure de ce que les abeilles récoltent.
L’échantillonnage
Grâce à leur activité, les butineuses d’une seule colonie d’abeilles mellifères visitent et « échantillonnent » chaque jour de nombreuses plantes sur une grande surface. Les abeilles solitaires visitent aussi de nombreuses fleurs en cherchant de la nourriture. Des techniques comme le décodage de la danse frétillante ont été utilisées pour déterminer la direction et la distance parcourue par les abeilles dans le but de trouver des ressources alimentaires (Couvillon et al., 2014, 2012). La danse frétillante est l’un des outils qui fait aussi appel à des messages chimiques transmis par des odeurs (Grüter et Farina, 2009), utilisés par les abeilles pour communiquer à leurs congénères l’information sur une bonne source de nourriture. Cette communication vise à recruter d’autres butineuses afin d’exploiter au maximum la source nutritive trouvée.
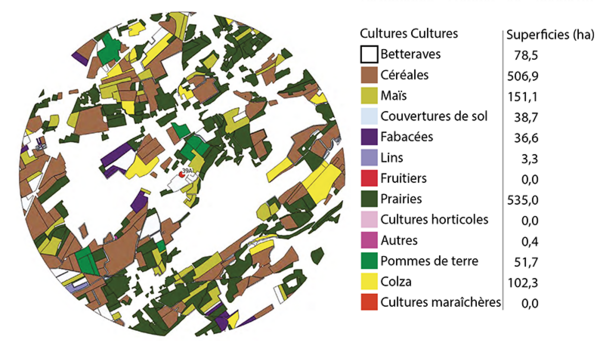
D’après les diverses études publiées décrivant les distances de butinage, nous savons aujourd’hui que les abeilles visitent les fleurs à proximité de leurs colonies et jusqu’à 15 km de distance de celle-ci (Beekman et Ratnieks, 2000 ; Couvillon et al., 2014). Ces distances dépendent de caractéristiques telles que le statut génétique et physiologique de la colonie, la teneur en sucre du nectar, et le temps ou la période de l’année (Couvillon et al., 2014). Dans les régions tempérées, les abeilles parcourent en moyenne 2 km en été, alors qu’elles volent en moyenne 500 m au printemps ou environ 1.3 km en automne. La figure 2 montre l’utilisation des terrains agricoles dans un rayon de 3 km autour d’un rucher (point rouge), comme illustration de la diversité des plantes cultivées qui pourraient être butinées par les abeilles de ce rucher. En plus de ces surfaces cultivées, les abeilles visitent des plantes sauvages, des flaques d’eau, de l’eau vive (ruisseaux…), et récoltent la résine de plantes de ces zones (représentées par les cercles de 3 km de rayon). Pendant leur butinage, elles recueillent aussi involontairement des particules en suspension dans l’air ou des substances diluées dans l’air (Girolami et al., 2012). Les analyses des produits qu’elles récoltent ou des abeilles elles-mêmes peuvent donc révéler d’un côté la diversité florale des environs, et d’un autre côté les polluants présents dans l’environnement sur une grande surface.
Diversité des pollens
Lors d’une étude de science citoyenne proposée par le réseau scientifique Coloss appelée C.S.I. Pollen, apiculteurs et chercheurs ont pu constater la diversité des pollens récoltés par les abeilles au long de l’année simplement en récoltant, divisant et comptant les pelotes de pollen de différentes couleurs. Malheureusement, les résultats ne sont pas encore disponibles. Si on évalue la composition botanique de ces pelotes à l’aide d’un microscope, nous avons une bonne description de la diversité botanique des environs. Une étude menée en Wallonie (Simon-Delso et al., 2014), montrait une diversité d’au moins huit types différents de pollens récoltés entre septembre et octobre, les pollens qui se retrouvent le plus fréquemment étant ceux de brassicaceae (probablement moutarde), lierre, trèfle et phacélie. Ces types d’études peuvent être très intéressants pour évaluer l’impact des mesures agri-environnementales envisagées par la politique agricole, car cela permet d’identifier le potentiel de diversité des paysages et proposer des éléments paysagers pour couvrir les périodes de l’année où des carences nutritionnelles pourraient exister chez les abeilles.
Des contaminants
Par contre, les produits de la ruche, étant très fortement liés à l’environnement du rucher, on y retrouve parfois divers contaminants environnementaux, notamment des métaux lourds, des produits phytopharmaceutiques (ci-après appelés pesticides), des hydrocarbures aromatiques polycycliques (produits résultants de la combustion), etc. Malheureusement, il est souvent impossible d’identifier les sources spécifiques de contamination. L’exposition des abeilles aux métaux lourds en Wallonie, mesurée à travers leur présence dans le miel, a été l’objet d’une étude publié dans Abeille & Cie 173 (Marie Warnier).
Les pesticides
Parmi tous les polluants mentionnés ci-dessus, ce sont les pesticides qui ont le plus de liens avec la mortalité et la morbidité (l’absence de santé ou la présence de signes de maladie) des abeilles. Ces substances chimiques peuvent être naturelles, semi-synthétiques ou synthétiques. L’utilisation de ces dernières a augmenté parallèlement au développement de l’agriculture industrialisée ou l’installation de cultures industrielles permanentes (vergers, vignobles, oliveraies, etc.) ou de monocultures, augmentant la productivité et la rationalisation de la production, mais favorisant aussi le développement des ravageurs. L’agriculture industrielle moderne contrôle la pression des ravageurs par l’utilisation de pesticides, même si, par principe, leur utilisation doit être rendue plus durable, du moins en Europe, suite à la mise en place d’une stratégie holistique intégrant également des outils agronomiques, génétiques et de gestion de risques dans la gestion de la culture (Parlement européen et Conseil 2009).
Air et eau
Pendant que les abeilles volent, les particules transportées par l’air peuvent se coller à leur corps poilu. Les analyses de ces abeilles ainsi contaminées ont révélé la présence d’une grande quantité de pesticides hautement toxiques, qui avaient été rejetés dans l’environnement à la suite de l’ensemencement de semences enrobées de pesticides à l’aide de semoirs pneumatiques
(Girolami et al., 2012,2013 ; Marzaro et al., 2011). Ces résultats expliquent les importants épisodes de pertes de colonies décrits par les apiculteurs depuis la commercialisation de semences traitées aux insecticides systémiques comme les néonicotinoïdes ou le fipronil (Bortolotti et al., 2009 ; Maxim et van der Sluijs, 2013 ; Pistorius et al., 2009). Les butineuses peuvent également transporter jusqu’à la ruche du nectar contaminé prélevé sur les fleurs ou de l’eau contaminée. La littérature décrit des valeurs moyennes de consommation d’eau de 20 à 40 l/colonie/année et en été jusqu’à 20 l/semaine/colonie ou 2.9 l/jour/colonie (EFSA, 2012). Les butineuses peuvent transporter sur leurs pattes arrières du pollen contaminé en pelotes ou des résines de plantes.
Contamination des produits de la ruche
Les matrices apicoles (miel, pollen, cire, abeilles) ont une tendance différente à être contaminée de par leurs caractéristiques physico-chimiques. Ce transfert du chimique vers la matrice est estimé sur base d’un paramètre appelé le coefficient de partition octanol/eau (Kow ou LogP), qui indique la tendance d’une substance à se dissoudre plutôt dans l’eau ou dans le gras. Des substances avec de faibles valeurs de Kow (p.ex. moins de 1) peuvent être considérées comme solubles dans l’eau, tandis que les valeurs plus élevées (p. ex. plus de 4) peuvent être considérées comme solubles dans le gras. Le pollen ayant des teneurs en lipides entre 0.4 % et 14.4 % de matière sec et étant plus exposé dans les fleurs, a plus de probabilité de contenir des polluants que le nectar, qui est une solution aqueuse sucrée secrétée dans des zones plus protégées de la fleur. Par contre, bien que les études menées montrent une plus grande contamination du pollen que du nectar, il est parfois surprenant de voir que le nectar, et parfois aussi le miel, peut être contaminé par des produits comme les néonicotinoïdes, qui sont solubles dans l’eau (voir Abeille & Cie 180). La propolis est une matrice assez complexe récoltée sur des plantes et composée de cire, résines, baumes, huiles aromatiques et éthérées, pollen et autres matières organiques (Ghisalberti et al.., 1978 ; Marcucci, 1995 ; Mercan et coll., 2006 ; Moreira et coll., 2008). Elle aussi peut alors contenir un grand nombre de contaminants. La gelée royale par contre, étant une sécrétion des abeilles, profite du filtre des nourrices et contient au maximum 1 % des quantités de contaminants présentes dans le pollen (Böhme et al., 2017).
Pour les consommateurs
En tant que consommateur informé et prudent, nous pourrions être tentés de ne plus manger ni pollen, ni miel ou de ne plus nous soigner avec la propolis ou la gelée royale. Mais il faut remettre cette exposition aux contaminants des produits de la ruche en contexte. Le rapport 2016 de l’autorité européenne de sécurité alimentaire (AESA) sur les résidus de pesticides dans les denrée alimentaires ne pointait pas le miel parmi les produits les plus contaminés. Si
97 % des échantillons analysés (82,649) restaient dans les limites maximums de résidus (LMR) établis légalement, 46.4 % ne contenait aucun résidu quantifiable. Les épinards, les haricots (avec gousses), les mandarines, les carottes et le riz, les poires, les oranges, les concombres, et le blé transformé (farine de froment) étaient, dans cet ordre, les aliments qui dépassaient le plus ces LMR. Si l’on tient compte de la teneur en multiples résidus, ce sont les mandarines (64,7 %), les oranges (60,5 %), les poires (57,6 %) et les concombres (26,6 %) qui contiennent les plus de résidus par échantillon. Des taux plus faibles ont été enregistrés pour les haricots (avec gousses) (19,2 %), les épinards (18,4 %), les carottes (16,2 %), la farine de blé (11,8 %), le riz (9,2 %) et les pommes de terre (7,5 %). La présence de résidus multiples de pesticides était faible dans les produits d’origine animale (0,9 % pour les muscles et la graisse de volaille et 0,1 % pour le foie (différentes espèces)) (EFSA, 2016). Avec cette image effrayante de ce qui peut être trouvé dans nos assiettes, nous pouvons considérer que les résidus que nous pouvons retrouver dans les produits de la ruches, en considérant la faible quantité consommée par rapport à d’autres produits, posent plutôt un problème pour les abeilles que pour nous, consommateurs. Surtout si l’on tient compte des caractéristiques bénéfiques de ces produits, la solution et l’avenir de notre consommation ne devrait pas passer par l’arrêt de leur consommation, mais plutôt par le fait de repenser la manière dont nous produisons de la nourriture.
Abeilles bioindicateurs
En outre, la santé et le développement des abeilles est aussi un bon indicateur de la qualité de l’environnement. Dans le cas des abeilles sociales comme les mellifères, une perte de colonie ou le dépérissement peut indiquer qu’il existe un problème potentiel dans les environs, s’il n’y a pas eu un défaut dans la gestion. En surveillant les tendances de pertes de colonies nous pouvons identifier des zones géographiques à risque et ensuite commencer à croiser les données pour voir ce qui se passe dans ces zones (Simon-Delso et al., 2014 ; Hallmann et al., 2017). Les abeilles solitaires peuvent même être un meilleur indicateur de la qualité de l’environnement car elles se sont montrées plus sensibles aux facteurs de stress environnementaux (Rundlöf et al. 2015). De plus, elles n’ont généralement pas d’apiculteurs derrière elles pour maintenir leur population. Les tendances au fil du temps et la géographie de la richesse en espèces d’abeilles solitaires ou insectes pollinisateurs ainsi que l’abondance des individus de chaque espèce fournissent une information précieuse de l’état de l’environnement. Les études les plus récentes montrent une situation que quelques uns ont identifié comme
« Insectageddon »1 (George Monbiot, 2017). Les inventaires d’abeilles réalisés au niveau de l’UE auxquelles les compétents experts belges ont participé, ont révélé des résultats inquiétants : sur les 44 % d’espèces européennes pour lesquelles des données sont disponibles, 9% sont considérées comme menacées d’extinction, tandis que 7,7 % des espèces ont montré une diminution de la population, 12,6 % sont relativement stables et 0,7 % sont en augmentation (Nieto et al., 2014). En 2017, un étude allemande décrit un déclin saisonnier de 76 % et un déclin au milieu de l’été de 82 % de la biomasse des insectes volants au cours des 27 années d’étude (Hallmann et al., 2017). Des analyses des facteurs de risque amenant à ce déclin excluent les caractéristiques de l’habitat, les changements climatiques ou l’utilisation des terres, et pointent l’intensification de l’agriculture, y compris l’utilisation des pesticides, le travail du sol à longueur d’année, l’utilisation accrue des engrais et la fréquence des mesures agronomiques, qui pourraient contribuer aux tendances négatives. La mortalité ou la morbidité des colonies est alors liée aux paysages contenant de nombreux polluants (Oomen et al., 2001 ; Smart et al., 2016a, 2016b), à une faible diversité des ressources nutritionnelles (Sgolastra et al., 2017 ; Woodcock et al., 2017) ou à une combinaison des deux. Par conséquent, l’état de santé et de développement des colonies peut aussi être utilisé comme bio-indicateur de la qualité de l’environnement qui les entoure.
Cet article, peut montrer une vision assez négative et même catastrophiste de la réalité. En revanche, il inclut des tendances assez généralisées dans le monde « développé ». Comme toujours c’est à nous êtres humains à travailler pour réduire l’impact de nos activités sur le monde.
1. http://www.monbiot.com/2017/10/23/insectageddon/
References :
- Beekman M, Ratnieks FLW. Long-range foraging by the honey-bee, Apis mellifera L. Functional Ecology. 2000 ;14 : 490–496.
- Böhme F, Bischoff G, Zebitz CP, Rosenkranz P, Wallner K. From field to food—will pesticide-contaminated pollen diet lead to a contamination of royal jelly ? Apidologie. : 1–8.
- Bortolotti L, Medrzycki P, Sabatini AG, Pochi D, Marinelli E, Masci A, et al. The Apener project - First results on the effects on honeybees of dust loss during the sowing of dressed corn seeds. 2009.
- Couvillon MJ, Pearce FCR, Harris-Jones EL, Kuepfer AM, Mackenzie-Smith SJ, Rozario LA, et al. Intra-dance variation among waggle runs and the design of efficient protocols for honey bee dance decoding. Biology open. 2012 ; BIO20121099.
- Couvillon MJ, Schürch R, Ratnieks FL. Waggle dance distances as integrative indicators of seasonal foraging challenges. PloS one. 2014 ;9 : e93495.
- EFSA. Scientific Opinion on the science behind the development of a risk assessment of Plant Protection Products on bees (Apis mellifera , Bombus spp . and solitary bees). EFSA Journal. 2012 ;10 : 1–275.
- EFSA. The 2014 European Union Report on Pesticide Residues in Food. EFSA Journal. 2016 ;14 : n/a-n/a. doi:10.2903/j.efsa.2016.4611
- European Parliament, Council of the European Union. Directive 2009/128/EC of the European Parliament and of the Council of 21 October 2009 establishing a framework for Community action to achieve the sustainable use of pesticides. 2009.
- Ghisalberti EL, Jefferies PR, Lanteri R, Matisons J. Constituents of propolis. Cellular and Molecular Life Sciences. 1978 ;34 : 157–158.
- Girolami V, Marzaro M, Vivan L, Mazzon L, Giorio C, Marton D, et al. Aerial powdering of bees inside mobile cages and the extent of neonicotinoid cloud surrounding corn drillers. Journal of Applied Entomology. 2013 ;137 : 35–44. Available : http://onlinelibrary.wiley.com/doi/10.1111/j.1439-0418.2012.01718.x/full
- Girolami V, Marzaro M, Vivan L, Mazzon L, Greatti M, Giorio C, et al. Fatal powdering of bees in flight with particulates of neonicotinoids seed coating and humidity implication. Journal of applied entomology. 2012 ;136 : 17–26.
- Grüter C, Farina WM. The honeybee waggle dance : can we follow the steps ? Trends in Ecology & Evolution. 2009 ;24 : 242–247.
- Hallmann CA, Sorg M, Jongejans E, Siepel H, Hofland N, Schwan H. More than 75 percent decline over 27 years in total flying insect biomass in protected areas. PLoS ONE12 (10) : e0185809. 2017 ;
- Holt EA, Miller SW. Bioindicators : using organisms to measure environmental impacts. Nature Education Knowledge. 2011 ;3 : 8.
- Marcucci MC. Propolis : chemical composition, biological properties and therapeutic activity. Apidologie. 1995 ;26 : 83–99.
- Marzaro M, Vivan L, Targa A, Mazzon L, Mori N, Greatti M, et al. Lethal aerial powdering of honey bees with neonicotinoids from fragments of maize seed coat. Bulletin of Insectology. 2011 ;64 : 119–126. 1.
- Maxim L, van der Sluijs J. Seed-dressing systemic insecticides and honeybees. Late Lessons from Early Warnings : Science, Precaution, Innovation. European Environment Agency (EEA). Copenhagen ; 2013. pp. 401–438.
- Mercan N, others. Antimicrobial activity and chemical compositions of Turkish propolis from different regions. African Journal of Biotechnology. 2006 ;5.
- Moreira L, Dias LG, Pereira JA, Estevinho L. Antioxidant properties, total phenols and pollen analysis of propolis samples from Portugal. Food and Chemical toxicology. 2008 ;46 : 3482–3485.
- Nieto A, Roberts SPM, Kemp J, Rasmont P, Kuhlmann M, Gracia Criado M, et al. European red list of bees. Luxembourg : Publication Office of the European Union. ; 2014.
- Oomen PA, Belzunces L, Pélissier C, Lewis G. Honey bee poisoning incidents over the last ten years, as reported by bee keepers in The Netherlands. Les Colloques. 2001 ;98 : 129–136.
- Pistorius J, Bischoff G, Heimbach U, Stähler M. Bee poisoning incidents in Germany in spring 2008 caused by abrasion of active substance from treated seeds during sowing of maize. Julius-Kühn-Archiv, Nr 423. Bucharest ; 2009.
- Rundlöf M, Andersson GKS, Bommarco R, Fries I, Hederström V, Herbertsson L, et al. Seed coating with a neonicotinoid insecticide negatively affects wild bees. Nature. 2015 ;521 : 77–80. doi:10.1038/nature14420.
- Sgolastra F, Porrini C, Maini S, Bortolotti L, Medrzycki P, Mutinelli F, et al. Healthy honey bees and sustainable maize production : why not ? Bulletin of Insectology. 2017 ;70 : 156–160.
- Simon-Delso N, San Martin G, Bruneau E, Minsart L-A, Mouret C, Hautier L. Honeybee Colony Disorder in Crop Areas : The Role of Pesticides and Viruses. Nascimento FS, editor. PLoS ONE. 2014 ;9 : e103073. doi:10.1371/journal.pone.0103073.
- Smart M, Pettis J, Rice N, Browning Z, Spivak M. Linking Measures of Colony and Individual Honey Bee Health to Survival among Apiaries Exposed to Varying Agricultural Land Use. PLOS ONE. 2016 ;11 : e0152685. doi:10.1371/journal.pone.0152685
- Smart MD, Pettis JS, Euliss N, Spivak MS. Land use in the Northern Great Plains region of the US influences the survival and productivity of honey bee colonies. Agriculture, Ecosystems & Environment. 2016 ;230 : 139–149.
- Woodcock BA, Bullock JM, Shore RF, Heard MS, Pereira MG, Redhead J, et al. Country-specific effects of neonicotinoid pesticides on honey bees and wild bees. Science. 2017 ;356 : 1393–1395. doi:10.1126/science.aaa1190
